


 数学奥赛暑假天天练南京大学出版社系列答案
数学奥赛暑假天天练南京大学出版社系列答案科目:高中化学 来源: 题型:
| A、测定中和热时,所用稀NaOH溶液和HCl的物质的量恰好相等以减小实验误差 |
| B、向Fe(OH)3胶体中通电,一段时间后,阴极附近颜色加深 |
| C、向FeCl3溶液中滴加NaOH溶液来制备Fe(OH)3胶体 |
| D、用乙醇萃取溴水中的溴时,分液时有机层从分液漏斗上口放出 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
| B、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
| C、氢氧化铜加到盐酸中:OH-+H+═H2O |
| D、将铜片加入到FeCl3溶液中,Cu+2Fe3+═Cu2++2Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
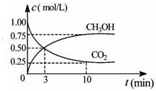
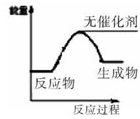 联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
联合国气候变化大会于2009年12月7-18日在哥本哈根召开.中国政府承诺,到2020年,单位GDP 二氧化碳排放比2005年下降40%-45%.
| ||
| ||
| ||
| 太阳光 |
| 高温 |
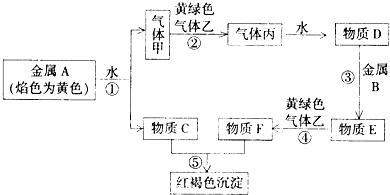
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
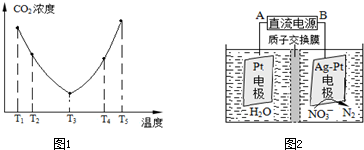
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
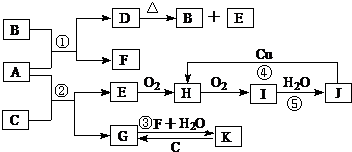
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com