
| A. | 凡有能量变化的过程都是化学变化 | |
| B. | 可逆反应进行的程度是不可改变的 | |
| C. | 化学键的断裂和形成是化学反应能量变化的主要原因 | |
| D. | 能自发进行的化学反应,一定是△H<0、△S>0 |
分析 A.物理变化中可伴随能量变化;
B.改变条件可使可逆反应发生移动;
C.化学反应中一定有化学键的断裂和生成,断裂化学键吸收能量,形成化学键释放能量;
D.△H-T△S<0的反应可自发进行.
解答 解:A.物理变化中可伴随能量变化,如浓硫酸稀释放热,故A错误;
B.改变条件可使可逆反应发生移动,如改变温度、压强使合成氨反应的进行程度发生变化,故B错误;
C.化学反应中一定有化学键的断裂和生成,断裂化学键吸收能量,形成化学键释放能量,则化学键的断裂和形成是化学反应能量变化的主要原因,故C正确;
D.△H-T△S<0的反应可自发进行,则能自发进行的化学反应,可能△H>0、△S>0,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、平衡移动、反应进行方向为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 只有① | B. | ②③ | C. | ①④ | D. | ①② |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 肯定不含I- | B. | 肯定不含SO42- | C. | 肯定不含SO32- | D. | 肯定含有NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 13653I是碘的一种同素异形体 | |
| B. | 13653I是一种新发现的元素 | |
| C. | 它的中子数是53 | |
| D. | 核内的中子数与核外电子数之差为30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32- 发生水解 | |
| C. | 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理 | |
| D. | 纯碱溶液呈碱性的原因是CO3 2-+H2O?HCO3-+OH- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
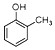 ③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )
③CH3OH ④CH3Cl ⑤CCl4⑥HCOOCH3 ⑦CH3COOCH2CH3 ⑧CH3COOH按物质类别不同可分为( )| A. | 4类 | B. | 5类 | C. | 6类 | D. | 8类 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com