
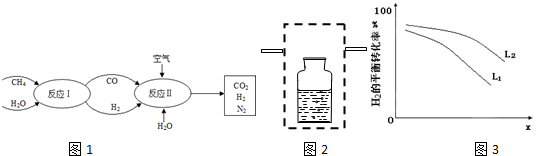
分析 (1)根据图1可知反应Ⅰ中反应物为甲烷和水,生成物为一氧化碳和氢气,根据元素守恒书写化学方程式;
(2)工业上选用K2CO3(aq)除去CO2,K2CO3(aq)吸收二氧化碳生成碳酸氢钾,碳酸氢钾经处理后又生成碳酸钾和二氧化碳,可循环利用,工业上除去CO2的反应在加压下进行,根据压强对平衡的影响分析,用K2CO3溶液吸收二氧化碳可用洗气装置;
(3)根据图3可知,随着x的增加,氢气的转化率减小,根据反应3H2(g)+N2(g)═2NH3 (g)△H<0,该反应为气体体积减小的放热反应,升高温度和减小压强都会使氢气的转化率减小,所以x代表温度,则L代表压强,据此答题.
解答 解:(1)根据图1可知反应Ⅰ中反应物为甲烷和水,生成物为一氧化碳和氢气,所以反应的化学方程式为CH4+H2O=CO+3H2,
故答案为:CH4+H2O=CO+3H2;
(2)工业上选用K2CO3(aq)除去CO2,K2CO3(aq)吸收二氧化碳生成碳酸氢钾,碳酸氢钾经处理后又生成碳酸钾和二氧化碳,可循环利用,反应的离子方程式为CO2+CO32-+H2O?2HCO3-,增大压强,平衡正向移动,有利于二氧化碳的吸收,用K2CO3溶液吸收二氧化碳可用洗气装置,装置图为 ,
,
故答案为:K2CO3(aq)吸收二氧化碳生成碳酸氢钾,碳酸氢钾经处理后又生成碳酸钾和二氧化碳,可循环利用;在反应CO2+CO32-+H2O?2HCO3-中,增大压强,平衡正向移动,有利于二氧化碳的吸收; ;
;
(3)根据图3可知,随着x的增加,氢气的转化率减小,根据反应3H2(g)+N2(g)═2NH3 (g)△H<0,该反应为气体体积减小的放热反应,升高温度和减小压强都会使氢气的转化率减小,所以x代表温度,则L代表压强,
①根据上面的分析可知,x代表温度,故答案为:温度;
②反应3H2(g)+N2(g)═2NH3 (g)中,在x即温度一定时,增大压强,平衡正向移动,氢气的平衡转化率增大,所以L2>L1,
故答案为:L2>L1,反应3H2(g)+N2(g)═2NH3 (g)中,在x即温度一定时,增大压强,平衡正向移动,氢气的平衡转化率增大.
点评 本题以制备CO和H2混合气及合成氨为载体考查了实验基本操作及实验原理分析和化学平衡等知识点,综合性较强,题目难度中等,侧重于考查学生的分析能力,注意把握化学方程式的书写、化学平衡移动的分析.


 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案科目:高中化学 来源: 题型:选择题
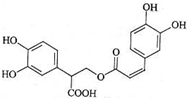
| A. | 迷迭香酸属于芳香烃 | |
| B. | 1mol迷迭香酸最多能和9mol氢气发生加成反应 | |
| C. | 迷迭香酸可以发生水解反应、消去反应和酯化反应 | |
| D. | 1mol迷迭香酸最多能和含6 mol NaOH的水溶液完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
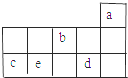 a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( )
a、b、c、d、e为元素周期表前3周期中的部分元素,它们在元素周期表中的相对位置如图所示.下列叙述正确的是( )| A. | b元素除0价外,只有一种化合价 | |
| B. | 五种元素中,c元素的性质最稳定 | |
| C. | d气态氢化物溶于水,溶液显碱性 | |
| D. | e元素最高价氧化物对应的水化物和不同量的氢氧化钠反应,可能生成三种盐 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
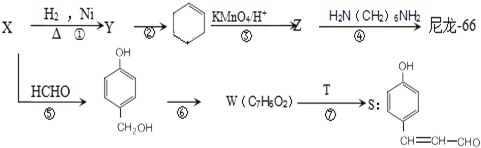
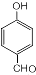 ,S的分子式为C9H8O2.
,S的分子式为C9H8O2.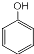 +HCHO$\stackrel{△}{→}$
+HCHO$\stackrel{△}{→}$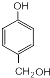 .
.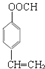 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{29}^{64}$Cu 的核电荷数为 29 | B. | ${\;}_{29}^{64}$Cu 的质子数为 35 | ||
| C. | ${\;}_{29}^{64}$Cu 的中子数为 64 | D. | ${\;}_{29}^{64}$的核外电子数为 64 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
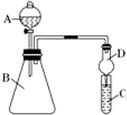 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 混合气体中一定有甲烷 | B. | 混合气体中一定有甲烷和乙烯 | ||
| C. | 混合气体中一定有乙炔 | D. | 混合气体中一定没有乙烷 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com