
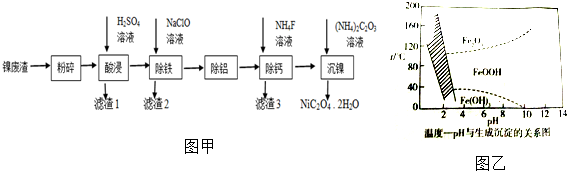
分析 废镍催化剂(成分主要为Ni,含有一定量的Al2O3、Fe、SiO2、CaO等),粉碎后用硫酸溶解,SiO2不与硫酸反应,过滤得到滤液中含有NiSO4、FeSO4、Al2(SO4)3、CaSO4及过量的硫酸,滤渣1为SiO2,滤液中加入次氯酸钠,将Fe2+氧化为Fe3+,同时调节pH,使Fe3+转化为Fe(OH)3沉淀,所以滤渣2为铁元素的沉淀,再经除铝,滤液中含有NiSO4、CaSO4,向滤液中加入NH4F,除去Ca 2+,过滤,再向滤液中加入(NH4)2C2O4,得到草酸镍沉淀,再过滤、洗涤、干燥得草酸镍晶体,
(1)根据影响反应速率的因素答题;
(2)根据图象可知,①若控制温度20℃、PH=5,则滤渣2的主要成分为 Fe(OH)3;
②若控制温度80℃、PH=4,则滤渣2的主要成分为FeOOH;
(3)氟化钙难溶于水,钙离子与氟离子能生成氟化钙沉淀;
(4)在沉镍的上层清液中继续加(NH4)2C2O4溶液,可判断Ni2+是否沉淀完全;
(5)根据甲醛与硫酸镍反应的方程进行计算氧化剂与还原剂的物质的量之比;
(6)①配制100ml的镀镍试剂时,需要的仪器除托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要100 mL容量瓶;
②根根据反应Ni2++H2Y2-=NiY2-+2H+,可知28.7g镀镍试剂中的Ni2+的物质的量为0.40mol.L-1×0.02500L×$\frac{100}{10}$=0.1mol,NiSO4的物质的量也为0.1mol,其质量为155×0.1g=15.5g,因为溶液中存在离子为SO42-、Ni2+、NH4+,所以镀镍试剂中还应有(NH4)2SO4,其质量为28.7g-15.5g=13.2g,其物质的量为$\frac{13.2}{132}$mol=0.1mol,据此推断出该镀镍剂的化学式.
解答 解:(1)根据影响反应速率的因素可知,镍废渣粉碎的目的是增大反应物的接触面积,提高反应速率,提高镍的浸出率,
故答案为:增大接触面积,加快反应速率,提高镍的浸出率;
(2)根据图象可知,①若控制温度20℃、PH=5,则滤渣2的主要成分为 Fe(OH)3,
故答案为:Fe(OH)3;
②若控制温度80℃、PH=4,则滤渣2的主要成分为FeOOH,发生反应的离子方程式为2Fe2++ClO-+3H2O=2FeOOH↓+Cl-+4H+,
故答案为:2Fe2++ClO-+3H2O=2FeOOH↓+Cl-+4H+;
(3)根据上面的分析可知,氟化钙难溶于水,钙离子与氟离子能生成氟化钙沉淀,所以滤渣3的主要成分为CaF2,
故答案为:CaF2;
(4)判断Ni2+是否沉淀完全的操作为静置分层,向上层清液中继续滴加(NH4)2C2O4溶液,若无明显现象,沉淀完全,
故答案为:静置分层,向上层清液中继续滴加(NH4)2C2O4溶液,若无明显现象,沉淀完全;
(5)甲醛与硫酸镍反应的方程式为H2O+HCHO+2NiSO4=CO2+2Ni+2H2SO4,其中甲醛是还原剂,硫酸镍为氧化剂,所以氧化剂与还原剂的物质的量之比2:1,
故答案为:2:1;
(6)①配制100ml的镀镍试剂时,需要的仪器除托盘天平、玻璃棒、烧杯、量筒、胶头滴管外,还需要100 mL容量瓶,
故答案为:100 mL容量瓶;
②根据反应Ni2++H2Y2-=NiY2-+2H+,可知28.7g镀镍试剂中的Ni2+的物质的量为0.40mol.L-1×0.02500L×$\frac{100}{10}$=0.1mol,NiSO4的物质的量也为0.1mol,其质量为155×0.1g=15.5g,因为溶液中存在离子为SO42-、Ni2+、NH4+,所以镀镍试剂中还应有(NH4)2SO4,其质量为28.7g-15.5g=13.2g,其物质的量为$\frac{13.2}{132}$mol=0.1mol,所以该镀镍剂的组成中NiSO4和(NH4)2SO4的物质的量之比为1:1,则该镍剂的化学式为(NH4)2Ni(SO4)2,
故答案为:(NH4)2Ni(SO4)2.
点评 本题考查了工业上从废镍催化剂制备草酸镍晶体的工艺流程,侧重考查物质分离的实验设计和方法应用,主要是利用溶液不同pH条件下离子沉淀的情况不同,控制溶液PH除去杂质离子,同时考查了除杂原则不能引入新的杂质,题目难度中等.


 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案科目:高中化学 来源: 题型:选择题
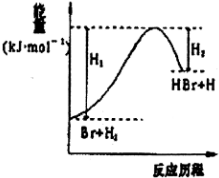
| A. | 该反应为可逆反应 | B. | 加入催化剂,可提高HBr的产率 | ||
| C. | 反应物总能量低于生成物总能量 | D. | 反应物总键能低于生成物总键能 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,PM2.5比胶体粒子小,因其比表面积大,故可吸附重金属离子,入肺后对人体产生很大的危害 | |
| B. | 工业用石灰石、纯碱和石英在高温下制得玻璃的原理与硅酸和碳酸的酸性强弱无关 | |
| C. | 以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| D. | 高纯度的二氧化硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCO3、BaSO4、Na2CO3 | B. | CuSO4、NaCl、NaCO3 | ||
| C. | NaCl、CuSO4、CaCO3 | D. | NaCl、KNO3、BaCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②⑤ | B. | ②④ | C. | ②④⑥ | D. | ③⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com