
| A. | Cu $\stackrel{浓HNO_{3}}{→}$Cu(NO3)2 | |
| B. | Cu$\stackrel{稀HNO_{3}}{→}$Cu(NO3)2 | |
| C. | Cu$→_{△}^{O_{2}(空气)}$ CuO$→_{△}^{稀HNO_{3}}$Cu(NO3)2 | |
| D. | Cu$→_{△}^{Cl_{2}}$CuCl2$\stackrel{AgNO_{3}溶液}{→}$ Cu(NO3)2 |
分析 铜与浓硝酸、稀硝酸反应中产生有毒气体一氧化氮、二氧化氮,既污染空气又浪费资源;铜与氯气生成氯化铜,氯化铜与硝酸银溶液反应生成硝酸铜的反应中,氯气有毒,且该方法生成的硝酸铜成本较高,不适合大量生产;若大量生产硝酸铜,应该先将铜与空气中氧气反应生成氧化铜,然后用稀硝酸溶解氧化铜获得硝酸铜,该方法既减小污染,又能够节约资源、降低成本,据此进行解答.
解答 解:A.Cu $\stackrel{浓HNO_{3}}{→}$Cu(NO3)2,该反应生成硝酸铜和二氧化氮,有有毒气体生成,且造成资源浪费,不适合大量生成硝酸铜,故A错误;
B.Cu$\stackrel{稀HNO_{3}}{→}$Cu(NO3)2,该反应生成硝酸铜和NO,NO为有毒气体,且造成硝酸的浪费,该方法不适合大量生成硝酸铜,故B错误;
C.Cu$→_{△}^{O_{2}(空气)}$ CuO$→_{△}^{稀HNO_{3}}$Cu(NO3)2,该方法既减小污染,又能够节约资源、降低成本,适合大量生成硝酸铜,故C正确;
D.Cu$→_{△}^{Cl_{2}}$CuCl2$\stackrel{AgNO_{3}溶液}{→}$ Cu(NO3)2,氯气有毒,且反应程序复杂,该方法制取的硝酸铜成本太高,不适合大量生成,故D错误;
故选C.
点评 本题考查了制备方案的设计与评价,题目难度不大,注意要适合大量生成,必须满足选取的原料成本低、产物中尽可能无污染物生成,且生成成本较低,试题侧重考查学生的分析能力及化学实验能力.


 快乐5加2金卷系列答案
快乐5加2金卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 1mol A和足量NaOH溶液反应,最多消耗11molNaOH | |
| B. | A在一定条件下能发生取代反应、加成反应和消去反应 | |
| C. | B能和浓溴水发生反应,1mol B最多消耗4molBr2 | |
| D. | C分子中含有手性碳原子. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
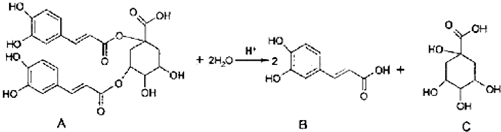
 )偶联可由下列两个途径制备有机化合物Ⅵ.
)偶联可由下列两个途径制备有机化合物Ⅵ.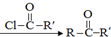
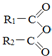 +H2O→R1-COOH+R2-COOH
+H2O→R1-COOH+R2-COOH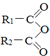

 .
. 、
、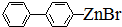 .
.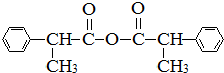 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
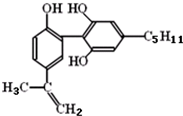
| A. | 该分子中所有碳原子一定共存于同一平面内 | |
| B. | 1mol该物质与浓溴水和H2反应时,最多消耗Br2和H2的物质的量分别为4mol、7mol | |
| C. | 遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物 | |
| D. | 滴入酸性KMnO4溶液,观察到紫色褪去,可证明分子中存在碳碳双键 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
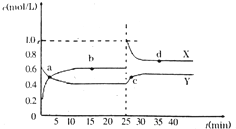
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12.5mL 16mol•L-1浓硫酸与足量锌反应,转移电子数为0.2NA | |
| B. | 1.8gNH4+与2.3gNa+所含电子数目均为NA | |
| C. | 7.8 gNa2S固体和7.8 gNa2O2固体中含有的阴离子数目均为0.1 NA | |
| D. | 常温常压下,92 gNO2和N2O4混合气体含有的原子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向正反应方向移动 | |
| B. | 前后两次平衡后,容器内的压强不相等次是相等 | |
| C. | SO2、O2的转化率均增大 | |
| D. | 通18O2前、通18O2后、重新到平衡后三个时间段,v(正)与v(逆)的关系依次是相等、大于、相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
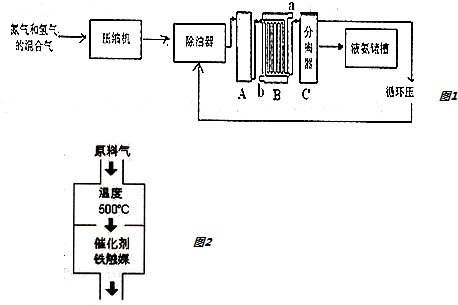
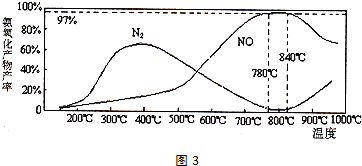
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com