
【题目】某酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,有同学设计了下列方案对废液进行处理(所加试剂均稍过量),以回收金属,保护环境。

请回答:
(1)沉淀a中含有的单质是_____________。
(2)沉淀c的化学式是___________________。
(3)溶液A与H2O2溶液在酸性条件下反应的离子方程式是_________________________。
【答案】 Cu、Fe BaCO3 ![]()
【解析】酸性废液中含有Fe2+、Cu2+、Ba2+三种金属离子,加入铁屑,可置换出铜,沉淀a为Fe、Cu,溶液A含有Fe2+、Ba2+,然后在溶液A中加入过氧化氢、氢氧化钠生成的红褐色沉淀为Fe(OH)3,溶液B含有Na+、Ba2+,加入碳酸钠溶液,可生成沉淀c为BaCO3,溶液C含有的阳离子主要为Na+。
(1)由以上分析可知沉淀a中含有的单质是Fe、Cu,故答案为:Fe、Cu;
(2)由分析可知沉淀c为BaCO3,故答案为:BaCO3;
(3)氧化时加入H2O2溶液与二价铁离子发生氧化还原反应,反应的离子方程式为2Fe2++2H++H2O2=2Fe3++2H2O,故答案为:2Fe2++2H++H2O2=2Fe3++2H2O。


科目:高中化学 来源: 题型:
【题目】下列图像分别表示有关反应的反应过程与能量变化的关系。
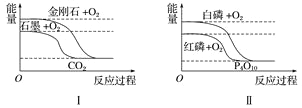
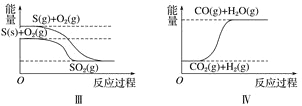
据此判断下列说法中正确的是( )
A. 石墨转变为金刚石是吸热反应 B. 白磷比红磷稳定
C. S(g)+O2(g)===SO2(g) ΔH1S(s)+O2(g)=SO2(g) ΔH2 则ΔH1>ΔH2 D. CO(g)+H2O(g)=CO2(g)+H2(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将6.4g铜与100g98%H2SO4在烧瓶中加热发生反应.
(1)铜完全溶解后,计算生成的气体在标准状况下的体积是多少?
(2)将反应后烧瓶中的物质配成500mL溶液. ①在配制过程中用到的仪器有;配制溶液时,若稀释后立即转移并定容,则所配得的溶液浓度(填“偏大”“偏小”或“不变”).
②求所配得溶液中H2SO4的物质的量浓度.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于甲烷和乙烯,下列说法正确的是
A. 甲烷能燃烧,乙烯不能 B. 甲烷和乙烯都能使溴水褪色
C. 甲烷和乙烯都能使酸性高锰酸钾溶液褪色 D. 甲烷和乙烯完全燃烧的产物都是CO2和H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】量取8.0 mL 5.0 mol·L-1 H2SO4溶液,加蒸馏水稀释至100 mL,取两份稀释后的H2SO4溶液各25 mL,分别加入等质量的Zn和Fe,相同条件下充分反应,产生氢气的体积随时间变化的曲线如图所示(氢气体积已折算成标准状况下的体积)。请计算:

(1)稀释后H2SO4溶液的物质的量浓度为________mol·L-1。
(2)加入Fe的质量至少有____________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:KClO3+6HCl(浓)═KCl+3Cl2↑+3H2O.如图所示,将少量试剂分别放入培养皿中的相应位置,实验时将浓盐酸滴在KClO3晶体上,并用表面皿盖好.下表中由实验现象得出的结论完全正确的是( )
选项 | 实验现象 | 结论 |
A | 滴有KSCN的FeCl2溶液变红 | Cl2具有还原性 |
B | 滴有酚酞的NaOH溶液褪色 | Cl2具有酸性 |
C | 石蕊试液先变红后褪色 | Cl2具有漂白性 |
D | KI淀粉溶液变蓝 | Cl2具有氧化性 |
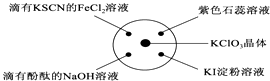
A.A
B.B
C.C
D.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学在生产和日常生活中有着重要的应用。下列说法正确的是( )
A. 相同温度下,HCN溶液的导电性比同物质的量浓度的盐酸弱可以证明HCN是弱电解质
B. 强电解质溶液稀释后,溶液中各种离子浓度一定都减小
C. 盐酸滴定氨水,可以选择酚酞为指示剂
D. 醋酸铵的水溶液显中性,所以该溶液中水的电离程度与相同条件下氯化钠溶液中水的电离程度相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com