
| A. | 氨水属于化合物 | |
| B. | 一水合氨属于电解质 | |
| C. | 氨气溶于水时,只有极少数氨气与水结合生成一水合氨 | |
| D. | 氨气能使湿润的蓝色石蕊试纸变红 |
分析 A、氨水是混合物;
B、一水合氨在水溶液中部分电离,属于弱电解质;
C、氨气极易溶于水,大部分氨气与结合生成一水合氨,氨与水结合生成的一水合氨(NH3•H2O),由于NH3•H2O为弱碱,只有小部分电离成NH4+和OH-;
D、氨气能使湿润的红色石蕊试纸变蓝.
解答 解:A、氨水是混合物,所以不是化合物,故A错误;
B、一水合氨在水溶液中部分电离,属于弱电解质,故B正确;
C、氨气极易溶于水,大部分氨气与结合生成一水合氨,氨与水结合生成的一水合氨(NH3•H2O),由于NH3•H2O为弱碱,只有小部分电离成NH4+和OH-,故C错误;
D、氨气能使湿润的红色石蕊试纸变蓝,而不是变红,故D错误.
故选B.
点评 本题考查学生对概念的把握:氨气、氨水、液氨、一水合氨四种物质的组成微粒的异同是解题的关键,本题难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
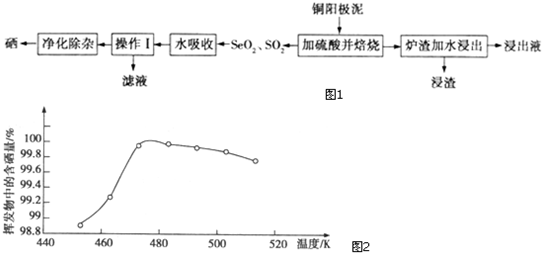
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol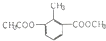 能与4molNaOH充分反应 能与4molNaOH充分反应 | |
| B. |  系统命名法为3-丁烯 系统命名法为3-丁烯 | |
| C. |  的碳原子都在一个平面内,且它的二氯代物为3种 的碳原子都在一个平面内,且它的二氯代物为3种 | |
| D. | 1mol 可以与4molH2发生加成 可以与4molH2发生加成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
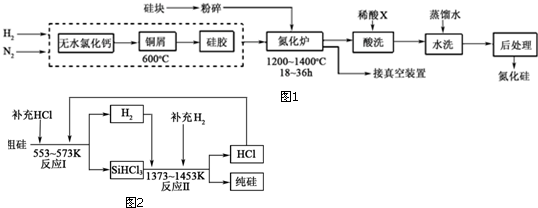
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 微粒半径Na+<K+<Cl-<S2- | B. | 稳定性HI>HBr>HCl>HF | ||
| C. | 酸性H2SiO3<H3PO4<H2SO4<HClO4 | D. | 碱性KOH>Ca(OH)2>Mg(OH)2>Al(OH)3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 测定时间/h | 0 | 1 | 2 | 3 | 4 |
| 雨水的PH | 4.79 | 4.62 | 4.55 | 4.55 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②③ | B. | 只有② | C. | 只有②③④ | D. | 全部正确 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X:3s23p1 Y:3s23p5 | B. | X:2s22p2 Y:2s22p4 | ||
| C. | X:3s23p1 Y:3s23p4 | D. | X:3s2 Y:2s22p3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4c-b+2a kJ | B. | $\frac{4c-b-2a}{2}$ kJ | C. | 4c+b-2a kJ | D. | $\frac{4c+b-2a}{2}$ kJ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com