
| A. | 40% | B. | 33.3% | C. | 60% | D. | 36% |
分析 HCHO燃烧生成二氧化碳与水,氢气燃烧生成水,反应方程式为HCHO+O2$\stackrel{点燃}{→}$CO2+H2O,2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,二氧化碳、水与过氧化钠反应2CO2+2Na2O2=2Na2CO3+O2,2H2O+2Na2O2=4NaOH+O2,通过方程式可以看出,固体质量的增加量就是原混合气体中HCHO、H2的质量和,据此可知原混合物中氧气的质量,从而可计算出混合物中氧气的质量分数.
解答 解:HCHO燃烧生成二氧化碳与水,氢气燃烧生成水,反应方程式为:HCHO+O2HCHO+O2$\stackrel{点燃}{→}$CO2+H2O、2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,
二氧化碳、水与过氧化钠反应为:2CO2+2Na2O2=2Na2CO3+O2、2H2O+2Na2O2=4NaOH+O2,
通过方程式可以看出,固体质量的增加量就是原混合气体中HCHO、H2的质量和,
Na2O2增重4g,所以HCHO、H2的质量和为4g,
所以混合气体中氧气的质量为:10g-4g=6g,
所以氧气的质量分数为:$\frac{6g}{10g/mol}$×100%=60%,
故选C.
点评 本题考查混合物反应的计算,题目难度中等,判断过氧化钠固体质量增加实质为氢气与一氧化碳的质量事实解题关键,试题培养了学生的分析能力及化学计算能力.


 轻松课堂单元期中期末专题冲刺100分系列答案
轻松课堂单元期中期末专题冲刺100分系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
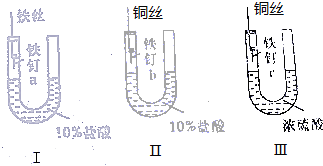 为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )
为了探究金属腐蚀的条件和快慢,某课外学习小组用不同的细金属丝将三根大小相同的普通铁钉分别固定在如图所示的三个装置内,并将这些装置在相同的环境中放置相同的一段时间,下列对实验结果的描述不正确的是( )| A. | 实验结束时,装置Ⅰ左侧的液面一定会下降 | |
| B. | 实验结束时,装置Ⅰ左侧的液面一定比装置Ⅱ的低 | |
| C. | 实验结束时,铁钉b腐蚀最严重 | |
| D. | 实验结束时,铁钉c几乎没有被腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25% | B. | 20% | C. | 35% | D. | 30% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
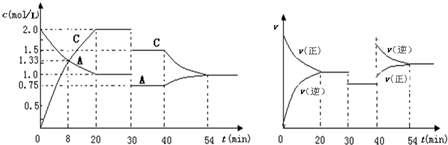
| A. | 0~20min用A物质表示反应的平均速率为0.005mol•L-1•min-1 | |
| B. | 该反应的正反应为吸热反应 | |
| C. | x=1,且30min时改变的反应条件是减压 | |
| D. | 在25min、35min、55min时化学平衡常数分别为K1、K2、K3,则K3>K2>K1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
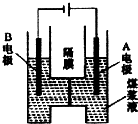 用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )
用惰性电极电解煤浆液的方法制H2的反应为C(s)+2H2O(l)=CO2(g)+2H2(g).现将一定量的1mol/LH2SO4溶液和适量煤粉充分混合,制成含碳量为0.02g/mL~0.12g/mL的煤浆液,置于如图所示装置中进行电解(两电极均为惰性电极).下列说法错误的是( )| A. | A极是阳极,B极为阴极 | |
| B. | A极的电极反应式为C+2H2O-4e-=CO2↑+4H+ | |
| C. | B极的电极反应式为2H++2e-=H2↑ | |
| D. | 电解一段时间后,煤浆液的pH增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com