
【题目】溴元素主要以Br-形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如图。已知:常温下溴呈液态,深红棕色,易挥发。
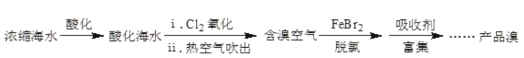
(1)氧化:请写出i中的化学方程式_____。
(2)脱氯:除去含溴空气中残留的Cl2。
①具有脱氯作用的离子是_____。
②溶液失去脱氯作用后,补加FeBr2或加入_____,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO![]() 和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式_____。
和Br-。再用H2SO4酸化后可以得到Br2。写出加入H2SO4酸化生成Br2的离子方程式_____。
(4)探究NaBr溶液与H2SO4溶液反应时H2SO4浓度对生成Br2的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1mol/LNaBr 20%H2SO4 | 1mol/LNaBr 98%H2SO4 | 将B中反应后溶液用水 稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_____。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由。若认为乙同学的分析合理,请进一步设计实验方案证明。请从甲乙同学的说法中任选一个作答。
认为甲合理的理由_____(具体反应)。
认为乙合理的实验方案_____。
【答案】Cl2+2Br-=2Cl-+ Br2 Fe2+、Br- 还原铁粉 BrO3- +5Br-+6H+=3Br2+3H2O Br2 若甲同学说法正确,则会发生反应:SO2+Br2+2H2O=2HBr+H2SO4,消耗了溴单质 若乙同学说法正确,则要把颜色很浅的溶液用CCl4萃取,利用CCl4密度比水大,溴单质容易溶于CCl4,观察下层液体颜色否呈棕红色即可
【解析】
由流程可知,海水浓缩、海水呈碱性,若不酸化,就会发生反应:Cl2+2OH-=Cl-+ClO-+H2O,影响溴的提取,故酸化后加氯气发生2Br+Cl2=Br2+2Cl,热空气吹出溴,且FeBr2或Fe均具有还原性,用Na2CO3溶液吸收溴,Br2歧化为BrO3-和Br-,再用H2SO4酸化歧化后的溶液得到Br2,发生5Br+BrO3+6H+=3Br2+3H2O,以此来解答。
(1)海水中溴元素以Br-存在,从海水中提取溴单质,要用Cl2氧化溴离子得到,Cl2+2Br-=2Cl-+ Br2;
(2)①将溴蒸气的残留的Cl2脱去,可利用氯气有强的氧化性,要加入能与Cl2反应,但不能与Br2反应的物质,如Fe2+、Br-;
②溶液失去脱氯作用后,补加FeBr2或加入还原铁粉,物质具有还原性,脱氯作用就恢复;
(3)用Na2CO3溶液吸收溴,Br2歧化为BrO3-和Br-。再用H2SO4酸化,BrO3- 和Br-及H+发生归中反应得到Br2,其离子反应方程式为BrO3- +5Br-+6H+=3Br2+3H2O;
(4)①B中溶液呈棕红色是由于Br2是红棕色物质,产生了Br2;
②若甲同学说法正确,则会发生反应:SO2+Br2+2H2O=2HBr+H2SO4,消耗了溴单质;
若乙同学说法正确,则要把颜色很浅的溶液用CCl4萃取,利用CCl4密度比水大,溴单质容易溶于CCl4,观察下层液体颜色是否呈棕红色即可。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某学生为探究AgCl沉淀的溶解和转化,其实验方案及记录如下:
步骤和现象 | 现象 |
Ⅰ.将等体积等浓度的AgNO3溶液和NaCl溶液混合,过滤,得滤液X和白色沉淀Y | |
Ⅱ.向滤液X 中滴加几滴饱和KI溶液 | 生成黄色沉淀M |
Ⅲ.取少量白色沉淀Y,滴加几滴饱和Na2S溶液 | 沉淀Y 转化为黑色沉淀Z |
Ⅳ.取少量白色沉淀Y,滴加几滴浓氨水 | 沉淀Y逐渐溶解 |
(1)由步骤Ⅱ的现象可推测,滤液 X 中除了含有Na+、NO3-,还含有的离子有_____。
(2)写出步骤Ⅲ中生成黑色沉淀 Z 的离子方程式为_________________,白色沉淀Y 转化为黑色沉淀 Z 的主要原因是___________。
(3)已知:Ag+ + 2NH3· H2OAg(NH3)2++2H2O,用平衡移动原理解释步骤Ⅳ中加入浓氨水沉淀逐渐溶解的原因__________________。
(4)为了进一步探究银的难溶化合物沉淀溶解的多样性,该同学又做了如下对比实验 V:
①取少量黑色沉淀 Z 和黄色沉淀 M,分置于两支试管中
②然后分别滴加同体积同浓度的稀硝酸,观察到黄色沉淀 M 不溶解,黑色沉淀 Z 溶解,并且有无色气体产生。综合实验Ⅱ至实验 V 的信息,下列预测正确的是__________
A.黑色沉淀 Z 比黄色沉淀 M 更难溶于水
B.黑色沉淀 Z 溶解于稀硝酸是因为发生了氧化还原反应
C.由步骤Ⅳ可以推测:实验室可用氨水洗涤银镜反应后的试管
D.在步骤Ⅳ之后,继续滴加浓硝酸后又有 AgCl 沉淀生成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质溶液的电导率越大,导电能力越强。用0.l00mol·L-1的NaOH溶液滴定10.00mL浓度均0.l00mol·L-1的盐酸和CH3COOH溶液。利用传感器测得滴定过程中洛液的电导率如下图所示。下列说法不正确的是( )
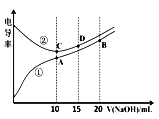
A. 曲线①代表滴定CH3COOH溶液的曲线
B. A点溶液中:c(CH3COO-)+c(OH-)-c(H+)=0.05mol·L-1
C. 在相同温度下,A、B、C三点溶液中水电离的c(H+):B<A=C
D. B点溶液中:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】500 mL KNO3和Cu(NO3)2的混合溶液中c(NO3-)=6.0 mol·L-1,用石墨做电极电解此溶液,当通电一段时间后,两极均收集到22.4 L气体(标准状况),假定电解后溶液体积仍为500 mL,下列说法正确的是( )
A. 原混合溶液中c(K+)为2 mol·L-1
B. 上述电解过程中共转移6 mol电子
C. 电解得到的Cu的物质的量为0.5 mol
D. 电解后溶液中c(H+)为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以TiO2为催化剂的光热化学循环分解CO2反应,为温室气体减排提供了一个新途径,该反应的机理及各分子化学键完全断裂时的能量变化如图所示。
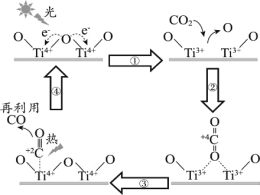
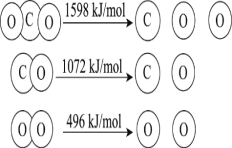
下列说法错误的是( )
A.过程①中吸收能量使钛氧键发生了断裂
B.该反应中,光能和热能转化为化学能
C.使用TiO2作催化剂可以提高化学反应速率
D.2mol二氧化碳完全分解成2mol一氧化碳和1mol氧气需要吸热30kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A—E为常见的有机物。以A为原料合成化合物E,其合成路线如图1所示。已知:A的产量通常用来衡量一个国家的石油化工水平;2CH3CHO+O2![]() 2CH3COOH。
2CH3COOH。
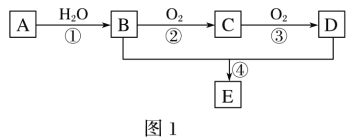
(1)A的分子式______。
(2)A中官能团的名称是_____;B中官能团的结构简式是_____。
(3)反应①的反应类型为_____;反应④的反应类型为_____。
(4)反应④的化学方程式为_____。
(5)某学习小组设计B催化氧化的实验装置如图,根据图2装置回答问题。

①装置甲锥形瓶中盛放的固体为过氧化钠,请写出甲中反应的化学方程式_____。
②B催化氧化的产物与葡萄糖具有相同的特征反应,将所得的氧化产物滴加到新制氢氧化铜悬浊液中加热,现象为_____。
③实验过程中,丙装置硬质玻璃管中发生反应的化学方程式为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列我国科技成果所涉及物质的应用中,发生的不是化学变化的是
|
|
|
|
A.甲醇低温所制氢气用于新能源汽车 | B.氘、氚用作“人造太阳”核聚变燃料 | C.偏二甲肼用作发射“天宫二号”的火箭燃料 | D.开采可燃冰,将其作为能源使用 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纳米TiO2具有十分宝贵的光学性质,在汽车工业及诸多领域都显示出美好的发展前景。如图是以硫酸氧钛为原料制备纳米二氧化钛的工艺流程图:
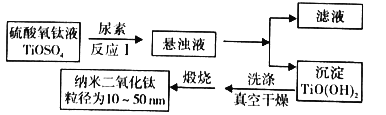
回答下列问题:
(1)反应1中发生两个反应,其一是尿素[CO(NH2)2]与H2O反应生成CO2和NH3·H2O,则另一反应的离子方程式为__。
(2)判断TiO(OH)2沉淀是否洗净的实验操作和现象是:__。
(3)为了减少制备过程中的“三废”排放,将上述流程中的“滤液”经过__、__、__(填基本操作)即可回收__(填化学式)。
(4)为研究反应温度、反应时间、反应物物质的量配比等因素对制备纳米二氧化钛产率的影响,设计如下实验。
实验编号 | 反应温度/℃ | 反应时间/h | 反应物物质的量配比n[CO(NH2)2]:n[TiO(OH)2] |
① | 90 | 1 | 2:1 |
② | 90 | 2 | 3:1 |
③ | 90 | 1 | |
④ | 110 | 2 | 3:1 |
实验②和④的实验目的是__,实验③中反应物物质的量配比为__。
(5)反应Ⅰ中TiO2+浓度对TiO2的产率和粒径的影响如图。结合图中信息,你认为为达到工艺目的,最合适的TiO2+浓度为__。
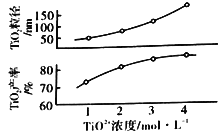
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,两电极一为碳棒,一为铁片,若电流表的指针发生偏转,且a极上有大量气泡生成,则以下叙述正确的是
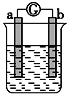
A. a为负极,是铁片,烧杯中的溶液为硫酸
B. b为负极,是铁片,烧杯中的溶液为硫酸铜溶液
C. a为正极,是碳棒,烧杯中的溶液为硫酸
D. b为正极,是碳棒,烧杯中的溶液为硫酸铜
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com