
25℃时,将0.02mol·L—1的HCOOH溶液与0.01mol·L—1的NaOH溶液等体积混合,所得溶液的pH<7。则下列关系式中不正确的是( )
A.c(HCOO—)> c(Na+) B.c(HCOOH)< c(HCOO—)
C.c(HCOOH)+ c(HCOO—)=0.02mol·L—1 D.2 c(H+)+ c(HCOOH)= c(HCOO—)+2 c(OH—)
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案科目:高中化学 来源: 题型:阅读理解
 某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:
某学生用0.1000mol/L KOH溶液滴定未知浓度的盐酸溶液,其操作可分解为如下几步:| 滴定次数 | 待测溶液体积/mL | 标准溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 20 | 1.02 | 21.03 |
| 2 | 20 | 2.00 | 25.00 |
| 3 | 20 | 0.60 | 20.6 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| 滴定次数 | 待测液体积 | 标准KOH溶液体积/ml | 滴定前读数/ml | 滴定后读数/ml | 第一次 | 20.00 | 0.02 | 25.00 | 第二次 | 20.00 | 0.01 | 25.03 | 第三次 | 20.00 | 0.03 | 26.35 |
查看答案和解析>>
科目:高中化学 来源: 题型:
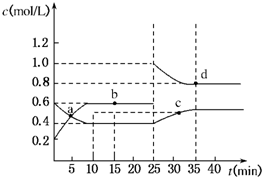 已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )
已知NO2与N2O4可相互转化:2NO2(g)?N2O4(g);△H=-24.2kJ/mol,在恒温下,将一定量NO2和N2O4(g)的混合气体充入体积为2L的密闭容器中,其中物质的浓度随时间变化的关系如图所示.下列推理分析合理的是( )| A、反应进行到10 min时,体系吸收的热量为9.68 kJ | B、前10 min内,用v(NO2)表示的反应速率为0.02 mol/(L?min) | C、a、b、c、d四点中v正与v逆均相等 | D、25 min时,导致平衡移动的原因是升温 |
查看答案和解析>>
科目:高中化学 来源:2013-2014学年高考化学二轮专题冲刺第7讲 水溶液中的离子平衡练习卷(解析版) 题型:填空题
(1)在25℃时,向浓度均为0.01 mol·L-1的MgCl2和AlCl3混合溶液中逐滴加入氨水,先生成________沉淀(填化学式),生成该沉淀的离子方程式为_____________________。(已知25℃时Ksp[Mg(OH)2]=1.8×10-11,Ksp[Al(OH)3]=3×10-34。)
(2)某温度(t℃)时,测得0.01 mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb=________。
(3)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=________。
(4)(2013·山东高考)25℃时,H2SO3 HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中
HSO3-+H+的电离常数Ka=1×10-2mol·L-1,则该温度下NaHSO3水解反应的平衡常数Kb=________mol·L-1,若向NaHSO3溶液中加入少量的I2,则溶液中 将________(填“增大”、“减小”或“不变”)。
将________(填“增大”、“减小”或“不变”)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省协作体高三5月第二次联考化学试卷(解析版) 题型:计算题
按要求完成下列各小题。
Ⅰ、CO和H2的混合气体俗称合成气,是一种重要的工业原料气,焦炭、天然气(主要成分为CH4)、重油、煤在高温下均可与水蒸气反应制得合成气。
(1)已知某反应的平衡常数表达式为:
它所对应的化学方程式为: 。
(2)向体积为2L的密闭容器中充入CH4和H2O(g)组成的混合气(共1mol),在一定条件下发生反应,并达到平衡状态,测得温度、压强、投料比X〔n(CH4)/n(H2O)〕对该反应的影响如图所示。

①图1中的两条曲线所示投料比的关系X2 ____ X1(填“=”“>”或“<”下同)
②图2中两条曲线所示的压强比的关系:P2 _______P1
(3)以CH4、O2为原料可设计成燃料电池:
①设装置中盛有150.0mL 1.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为4.48L,假设放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为:
②以H2SO4溶液代替KOH溶液为电解质溶液,将CH4改为C6H12O6 ,则燃料电池的负极反应式为:
。
Ⅱ、(1)某温度(t℃)时,测得0.01mol·L-1的NaOH溶液的pH=11。在此温度下,将pH=2的H2SO4溶液VaL与pH=12的NaOH溶液VbL混合,若所得混合液为中性,则Va︰Vb= 。
(2)在25℃时,将c mol·L-1的醋酸溶液与0.02 mol·L-1NaOH溶液等体积混合后溶液刚好呈中性,用含c的代数式表示CH3COOH的电离常数Ka=____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com