
| �ձ��� | V��ˮ ��mL�� | Vˮ��mL�� | c ��NH3?H2O�� ��mol?L-1�� | c��OH-�� | Kb | �� |
| 1 | 50.00 | 0.00 | 1.34��10-3 | |||
| 2 | 25.00 | 25.00 | 9.48��10-4 | |||
| 3 | 5.00 | 45.00 | 4.24��10-4 |
| 1.34��10-3��1.34��10-3 |
| 0.1 |
| 9.48��10-4��9.48��10-4 |
| 0.05 |
| 4.24��10-4��4.24��10-4 |
| 0.01 |
| 1.34��10-3 |
| 0.1 |
| 9.48��10-4 |
| 0.05 |
| 4.24��10-4 |
| 0.01 |
| �ڡ�3+�ۡ�2 |
| 5 |
| 3��H2+2��H3 |
| 5 |
| 3��H2+2��H3 |
| 5 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ��Ķ�����
�����Ź㷺����;��������ڻ��ʡ����ᡢ�ϳ���ά�ȹ�ҵ����������ˮ��Һ�д��ڵ���ƽ�⣬���õ��볣��Kb�͵���Ȧ���������ʾ�����̶ȡ�Kb�ͦ����õIJⶨ��������һ���¶�ʱ����ȼƲⶨһϵ����֪Ũ�Ȱ�ˮ��pH���ɵø�Ũ�Ȱ�ˮ��Ӧ��c(OH-)��Ȼ��ͨ��������ø���Ӧ�Ħ�ֵ��Kbֵ��������ij��ѧ��ѧ��ȤС����25��ʱ�ⶨһϵ��Ũ�Ȱ�ˮ��pH����Ӧ��c(OH-)��
���������Լ�����ȼơ�50 mL��ʽ�ζ��ܡ�100mL�ձ��� 0.10 mol��L-1 ��ˮ
��ʵ�����ݡ�(���������)
| �ձ��� | V��ˮ (mL) | Vˮ(mL) | c (NH3��H2O) ��mol��L-1�� | c(OH-) | Kb | �� |
| 1 | 50.00 | 0.00 |
| 1.34��10-3 |
|
|
| 2 | 25.00 | 25.00 |
| 9.48��10-4 |
|
|
| 3 | 5.00 | 45.00 |
| 4.24��10-4 |
|
|
�����������Ϣ�ش��������⣺
��1��25��ʱ����ˮ�ĵ��볣����Kb![]() �� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ �� ��
�� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ �� ��
��2����0.10mol��L��1����ֱ�ζ�20.00mL0.10mol��L��1��NaOH��Һ��20.00mL0.10mol��L��1
��ˮ���õĵζ��������£�
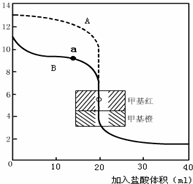
��ָ������ζ���ˮ������Ϊ �� ����A��B������д������a������Ӧ����Һ�и�����Ũ���ɴ�С������˳�� �� ��
��3��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�����ȼ�����������صķ�Ӧ�У�
4NH3��g��+3O2��g��= 2N2��g��+6H2O��l�� ��H1 ��
4NH3��g��+5O2��g��= 4NO��g��+6H2O��l�� ��H2 ��
4NH3��g��+6NO��g��= 5N2��g��+6H2O��l�� ��H3 ��
��д������������Ӧ�С�H1����H2����H3����֮���ϵ�ı���ʽ����H1= �� ��
��4��Allis-Chalmers���칫˾���ֿ����ð���Ϊȼ�ϵ�ص�ȼ�ϡ����ܷ�ӦʽΪ4NH3+3O2=2N2+6H2O�������ϵĵ缫��ӦʽΪO2+2H2O+4e��=4OH�������ϵĵ缫��ӦʽΪ �� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2011���㽭ʡ̨���и����������⣨���ۣ���ѧ���� ���ͣ������
�����Ź㷺����;��������ڻ��ʡ����ᡢ�ϳ���ά�ȹ�ҵ����������ˮ��Һ�д��ڵ���ƽ�⣬���õ��볣��Kb�͵���Ȧ���������ʾ�����̶ȡ�Kb�ͦ����õIJⶨ��������һ���¶�ʱ����ȼƲⶨһϵ����֪Ũ�Ȱ�ˮ��pH���ɵø�Ũ�Ȱ�ˮ��Ӧ��c(OH-)��Ȼ��ͨ��������ø���Ӧ�Ħ�ֵ��Kbֵ��������ij��ѧ��ѧ��ȤС����25��ʱ�ⶨһϵ��Ũ�Ȱ�ˮ��pH����Ӧ��c(OH-)��
���������Լ�����ȼơ�50 mL��ʽ�ζ��ܡ�100mL�ձ��� 0.10 mol��L-1��ˮ
��ʵ�����ݡ�(���������)
| �ձ��� | V��ˮ (mL) | Vˮ(mL) | c (NH3��H2O)��mol��L-1�� | c(OH-) | Kb | �� |
| 1 | 50.00 | 0.00 | | 1.34��10-3 | | |
| 2 | 25.00 | 25.00 | | 9.48��10-4 | | |
| 3 | 5.00 | 45.00 | | 4.24��10-4 | | |
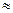 �� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ �� ��
�� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ �� ��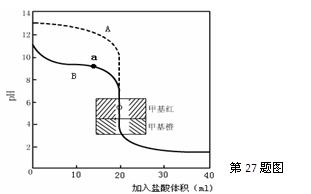
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2010-2011ѧ���㽭ʡ̨���и����������⣨���ۣ���ѧ���� ���ͣ������
�����Ź㷺����;��������ڻ��ʡ����ᡢ�ϳ���ά�ȹ�ҵ����������ˮ��Һ�д��ڵ���ƽ�⣬���õ��볣��Kb�͵���Ȧ���������ʾ�����̶ȡ�Kb�ͦ����õIJⶨ��������һ���¶�ʱ����ȼƲⶨһϵ����֪Ũ�Ȱ�ˮ��pH���ɵø�Ũ�Ȱ�ˮ��Ӧ��c(OH-)��Ȼ��ͨ��������ø���Ӧ�Ħ�ֵ��Kbֵ��������ij��ѧ��ѧ��ȤС����25��ʱ�ⶨһϵ��Ũ�Ȱ�ˮ��pH����Ӧ��c(OH-)��
���������Լ�����ȼơ�50 mL��ʽ�ζ��ܡ�100mL�ձ��� 0.10 mol��L-1 ��ˮ
��ʵ�����ݡ�(���������)
|
�ձ��� |
V��ˮ (mL) |
Vˮ(mL) |
c (NH3��H2O) ��mol��L-1�� |
c(OH-) |
Kb |
�� |
|
1 |
50.00 |
0.00 |
|
1.34��10-3 |
|
|
|
2 |
25.00 |
25.00 |
|
9.48��10-4 |
|
|
|
3 |
5.00 |
45.00 |
|
4.24��10-4 |
|
|
�����������Ϣ�ش��������⣺
��1��25��ʱ����ˮ�ĵ��볣����Kb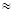 �� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ
�� ��
�� ��ͨ���������õ����ݺͼ�������˵�����볣�����������������ʵij�ʼŨ�ȵĹ�ϵ
�� ��
��2����0.10mol��L��1����ֱ�ζ�20.00mL0.10mol��L��1��NaOH��Һ��20.00mL0.10mol��L��1
��ˮ���õĵζ��������£�
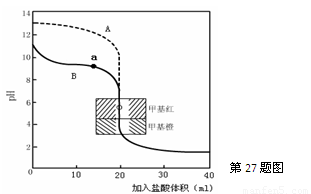
��ָ������ζ���ˮ������Ϊ �� ����A��B������д������a������Ӧ����Һ�и�����Ũ���ɴ�С������˳�� �� ��
��3��Һ����Ϊһ��DZ�ڵ��������ȼ����Խ��Խ���о���Ա���ӡ����ڰ�ȫ�ԡ��۸�ȷ���ϻ�ʯȼ�Ϻ���ȼ�����Žϴ�����ơ�����ȼ�����������صķ�Ӧ�У�
4NH3��g��+3O2��g��= 2N2��g��+6H2O��l�� ��H1 ��
4NH3��g��+5O2��g��= 4NO��g��+6H2O��l�� ��H2 ��
4NH3��g��+6NO��g��= 5N2��g��+6H2O��l�� ��H3 ��
��д������������Ӧ�С�H1����H2����H3����֮���ϵ�ı���ʽ����H1= �� ��
��4��Allis-Chalmers���칫˾���ֿ����ð���Ϊȼ�ϵ�ص�ȼ�ϡ����ܷ�ӦʽΪ4NH3+3O2= 2N2+6H2O�������ϵĵ缫��ӦʽΪO2+2H2O+4e��=4OH�������ϵĵ缫��ӦʽΪ �� ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com