
已知某酸性溶液中存在较多的Cu2+、NO3-,则该溶液中还可能大量存在的离子组是
A.OH-、CO32-、Na+ B.SO42-、Cl-、NH4+
C.ClO-、HCO3-、K+ D.Br-、Fe2+、Ba2+
 备战中考寒假系列答案
备战中考寒假系列答案科目:高中化学 来源:2016-2017学年河北省高一上学期第一次月考化学试卷(解析版) 题型:填空题
(1)在同温同压下,同体积的甲烷(CH4)和二氧化碳分子数之比___________,原子总数之比为____________,质量之比为____________,密度之比为____________。
(2)在标准状况下,4g H2、11.2L O2、1 mol H2O中,所含分子数最多的是___________,质量最大的是____________,体积最小的是____________。
查看答案和解析>>
科目:高中化学 来源:2017届河南省高三上学期9月月考化学试卷(解析版) 题型:选择题
甲乙丙丁戊是中学常见的无机物,他们的转化关系如图所示(某些条件和部分产物已略去)。下列说法错误的是

A.若戊为一种强碱且焰色反应为黄色,则反应①②可能都属于氧化还原反应
B.常温下,若丙为无色气体,戊为红棕色气体,则甲、乙是铜和稀硝酸
C.若甲为硫磺燃烧产物,丁为水,则戊可用于干燥甲
D.若甲为浓盐酸,乙为MnO2,则戊可能使品红褪色
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:实验题
为提高资源的利用率,可以将富锰渣(主要成分为Mn、SiO2、Al2O3、Fe)里面的锰再提炼以利用。下图为由富锰渣制备无水氯化锰的工艺流程,回答下列问题:
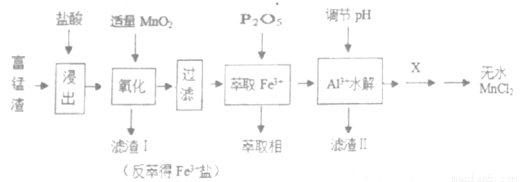
(1)“浸出”前将富锰渣粉碎成细颗粒,其目的是 。
(2)滤渣I的主要成分是 (填化学式)。
(3)加入MnO2氧化时,发生反应的离子方程式为 。
(4)结合下表数据(25℃),应调节pH的范围为 ,从下表中数据计算可得Al(OH)3的溶度积,该温度下Ksp[Al(OH)3]约为 。
离子 | 开始沉淀时的pH | 完全沉淀时的pH | 沉淀开始溶解时的pH |
Al3+ | 4.0 | 5.2 | 7.8 |
Mn2+ | 8.8 | 10.4 | 14 |
(5)已知MnCl2溶液呈弱酸性,操作X为 (填字母序号)。
A.蒸发结晶 B.降温结晶 C.渗析 D.盐析
(6)MnO2的生产方法之一是以惰性电极电解MnCl2和HCl混合溶液,阳极的电极反应是 。
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列说法正确的是
A.12g石墨和C60的混合物中质子总数为6NA
B.1LpH=1的硫酸溶液中含有的H+数为0.2NA
C.78gNa2O2固体中含有的阴离子数为2NA
D.500ml 2mol·L-1FeCl3溶液中Fe3+数为NA,且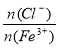 =3
=3
查看答案和解析>>
科目:高中化学 来源:2017届江西省高三上学期第一次段考化学卷(解析版) 题型:选择题
下列说法不正确的是
A | B | C | D |
铝制饭盒
| 聚乙烯盒
| 铁罐车
| 带玻璃塞的试剂瓶
|
不宜长时间存放酸性或碱性的食物 | 能用于盛放食品 | 可用于运输浓硫酸 | 可用于盛放氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期第一次月考化学试卷(解析版) 题型:选择题
实验表明,在一定条件下,乙烯和水的反应可表示为:
C2H4(g) + H2O (g) = C2H5OH(g) ΔH = -45.8 kJ/mol
则下列说法中正确的是( )
A.实验中,乙烯的用量不会影响该反应的反应焓变ΔH
B.0.5 mol H2O(l) 完全反应放出的热量为22.9 kJ
C.1 mol C2H5OH(g)具有的能量大于1 mol C2H4(g)和1 mol H2O (g)所具有的能量和
H2O (g)所具有的能量和
D.1 mol C2H4(g)和1 mol H2O (g)中化学键的总键能大于1 mol C2H5OH(g)中化学键的总键能
查看答案和解析>>
科目:高中化学 来源:2016-2017学年吉林省高二上学期9月月考化学试卷(解析版) 题型:填空题
某研究性学习小组将下列装置如图连接,C、D、E、F、X、Y都是惰性电极。将电源接通后,向乙中滴入酚酞试液,在F极附近显红色。试回答下列问题:

(1)电源A极的名称是____________。
(2)甲装置中电解反应的总化学方程式:_______________。
(3)如果收集乙装置中产生的气体,两种气体的体积比是____________。
(4)欲用丙装置给铜镀银,G应该是____________(填“铜”或“银”),电镀液的主要成分是________ (填化学式)。
(5)装置丁中的现象是_______________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省高二上第一次段考化学卷(解析版) 题型:填空题
I.(1)根据如图所示情况,判断下列说法中正确的是 。
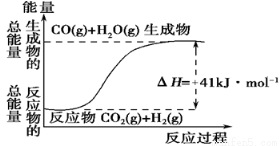
A.其热化学方程式为:CO(g)+ H2O(g)=CO2(g) + H2(g) ΔH=41 kJ·mol-1
B.该反应为吸热反应
C.该反应为放热反应
D.若当H2O为液态时反应热为ΔH2,则ΔH2>ΔH
(2)25℃、101 kPa下,已知1g氢气完全燃烧生成液态水时放出142.9 kJ的热量,表示氢气燃烧热的热化学方程式是 。
(3)已知反应:N2(g) + O2 (g)=2NO(g) △H1
2H2(g)+ O2(g)=2H2O(g) △H2
N2(g)+3H2(g)=2NH3(g) △H3
利用上述三个反应,计算4NH3(g)+5O2(g)=4NO(g)+6H2O(g) △H4 的反应焓变为 (用含△H1 、△H2、△H3的式子表示)。
、△H2、△H3的式子表示)。
(4)碘及其化合物在合成杀菌剂、药物等方面具有广泛用途.回答下列问题:
①大量的碘富集在海藻中,用水浸取后浓缩,再向浓缩液中加MnO2和H2SO4,即可得到I2,该反应的离子方程式为 。
②已知反应2HI(g)  H2(g)+I2(g) 的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
H2(g)+I2(g) 的△H=+11kJ•mol-1,1molH2(g)、1molI2(g)分子中化学键断裂时分别需要吸收436kJ、151kJ的能量,则1molHI(g)分子中化学键断裂时需吸收的能量为 kJ。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com