
【题目】某学习小组通过查阅资料发现用KClO3和浓盐酸也可以制备氯气。为此该小组利用如图装置在实验室制取Cl2并探究其有关性质:
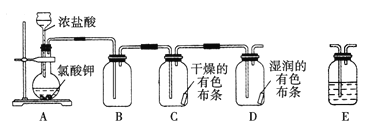
(1)装置A中存在一处错误,改正这处错误:______________。
(2)配平装置A中发生反应的化学方程式:____KClO3+____HCl(浓)=__KCl+___Cl2↑+___H2O,此反应中氧化产物与还原产物的物质的量之比为 ____________。请用单线桥标出该反应电子转移的方向和数目 ____________________。
(3)为了除去氯气中的氯化氢,需要在装置A、B之间添加装置E,装置E中所盛装的试剂为____。为了探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,装置E在整套装置中的添加位置为____(选填序号)。
a.A、B之间 b.B、C之间 c.C、D之间 d.D之后
(4)将氯气通入冷的石灰乳中,即可制得以______________(填化学式)为有效成分的漂白粉,发生反应的化学方程式为__________________________。
(5)另外一个学习小组就环境保护方面指出了上述装置的缺陷并给出了改进措施。该改进措施是____。
【答案】改长颈漏斗为分液漏斗 1;6;1;3;3 5:1 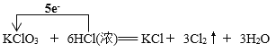 饱和食盐水 b Ca(ClO)2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 在装置D后增加一个盛装碱液的装置,吸收逸出的氯气
饱和食盐水 b Ca(ClO)2 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O 在装置D后增加一个盛装碱液的装置,吸收逸出的氯气
【解析】
A装置反应生成氯气,B中收集氯气,应该干燥后再通入C中,干燥的有色布条不褪色,D中湿润的有色布条褪色,检验有漂白性的物质是次氯酸,最后缺少尾气处理装置。
(1)装置中反应试剂是浓盐酸易挥发,需要用分液漏斗加入,改长颈漏斗为分液漏斗;故答案为:改长颈漏斗为分液漏斗;
(2)氯酸钾和浓盐酸反应生成氯气,氯化钾和水,氯元素发生归中反应,反应的化学方程式为:KClO3+6HCl=KCl+3Cl2↑+3H2O;在3molCl2用中有0.5mol是还原产物,2.5mol是氧化产物,氧化产物与还原产物的物质的量之比为5:1,单线桥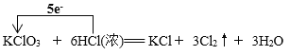 ;
;
(3)制备出的氯气含有挥发出的氯化氢,通过饱和食盐水可以除去,减小氯气的溶解性;探究使有色布条褪色的是氯气还是氯气与水反应的生成物,需要在整套装置中添加装置E,其中加入浓硫酸,应在C装置前干燥氯气,选择装置B、C之间;故答案为:饱和食盐水;b;
(4)氯气与石灰乳反应生成氯化钙和次氯酸钙,反应方程式为2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O,漂白粉的主要成分为CaCl2和Ca(ClO)2,其中Ca(ClO)2为漂白粉的有效成分,故答案为:Ca(ClO)2;2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O;
(5)氯气有毒排放到空气中污染环境,需要尾气吸收装置,在装置D后增加一个盛装浓碱液的装置,使碱液吸收逸出的氯气尾气,故答案为:在装置D后增加一个盛装碱液的装置,吸收逸出的氯气。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
【题目】在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如下表:
物质 | X | Y | Z |
初始浓度/( mol·L1) | 0.1 | 0.2 | 0 |
平衡浓度/( mol·L1) | 0.05 | 0.05 | 0.1 |
下列说法正确的是
A.反应达到平衡时,X和Y的转化率相等
B.增大压强使平衡向生成Z的方向移动,平衡常数增大
C.反应可表示为X+3Y![]() 2Z,其平衡常数为1600
2Z,其平衡常数为1600
D.若该反应的正反应方向为放热反应,升高温度,化学反应速率增大,反应的平衡常数也增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示装置,密闭容器内分别充入空气和H2、O2的混合气体在可移动的活塞两边,在室温下若将H2、O2的混合气体点燃引爆,活塞先左弹,恢复室温后,活塞右滑停留于容器的中央,则原来H2、O2的体积比最接近于( )
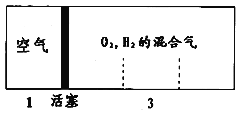
A.5:2B.4:5C.4:7D.2:7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A,B,C,D四种短周期元素的原子半径依次减小,D能分别与A,B,C形成电子总数相等的分子X、Y、Z。C原子的最外层电子排布为nsnnp2n。E的原子序数为29。
(1)A,B,C的第一电离能由小到大的顺序为________(用元素符号表示)。
(2)X是含有________键(填“非极性”或“极性”,下同)的________分子。
(3)A的一种氢化物的相对分子质量为26,其分子中的σ键与π键的键数之比为________。
(4)Y分子的空间构型为__________,其中心原子采取________杂化。
(5)一种由B,C组成的化合物与AC2互为等电子体,其化学式为________。
(6)Y是一种易液化的气体,请简述其易液化的原因_________。
(7)写出E2+的电子排布式___________________,并写出E2+在Z中通入足量Y得到深蓝色溶液的离子反应方程式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用下图装置可以测定混合气体中ClO2的含量:
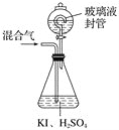
Ⅰ.在锥形瓶中加入足量的碘化钾,用50mL水溶解后,再加入3mL稀硫酸;
Ⅱ.在玻璃液封装置中加入水,使液面没过玻璃液封管的管口;
Ⅲ.将一定量的混合气体通入锥形瓶中吸收;
Ⅳ.将玻璃液封装置中的水倒入锥形瓶中;
Ⅴ.用0.100 0mol·L-1硫代硫酸钠标准溶液滴定锥形瓶中的溶液(I2+2S2O32-=2I-+S4O62-),指示剂显示终点时共用去20.00 mL硫代硫酸钠溶液。在此过程中:
(1)锥形瓶内ClO2与碘化钾反应的离子方程式为____________________________。
(2)玻璃液封装置的作用是_______________________。
(3)V中加入的指示剂通常为_____,滴定至终点的现象是_______。
(4)测得混合气中ClO2的质量为________ g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,2个X分子反应生成1个Y分子和3个Z分子,下列判断不正确的是
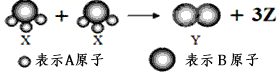
A.根据质量守恒定律可推知,1个Z分子中含有2个同种元素的原子
B.X、Y、Z三种物质均属于非电解质
C.该反应属于氧化还原反应
D.该反应属于分解反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按题目要求填写下列空白。
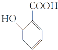
(1) ![]() 按官能团的不同分类,有机物类型为________类。
按官能团的不同分类,有机物类型为________类。
(2) 中官能团的名称是________________。
中官能团的名称是________________。
(3)键线式![]() 表示的有机物的结构简式是____________。
表示的有机物的结构简式是____________。
(4)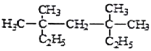 系统命名法为_________________。
系统命名法为_________________。
系统命名法命名有机物时应注意的问题_______ 、 _______(至少写两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物的结构简式如图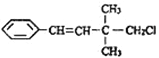 ,关于该有机物的下列叙述中不正确的是( )
,关于该有机物的下列叙述中不正确的是( )
A. 一定条件下,能发生加聚反应
B. 1mol该有机物在一定条件下最多能与4molH2发生反应
C. 能使酸性KMnO4溶液、溴水褪色,且原理相同
D. 该有机物苯环上的一溴代物有3种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Y是合成香料、医药、农药及染料的重要中间体,可由X在一定条件下合成如下,下列说法错误的是

A. Y的分子式为![]()
B. 由X制取Y的过程中可得到乙醇
C. 一定条件下,Y能与5mol![]() 发生加成反应
发生加成反应
D. 等物质的量的X、Y分别与![]() 溶液反应,最多消耗
溶液反应,最多消耗![]() 的物质的量之比为1:1
的物质的量之比为1:1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com