


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
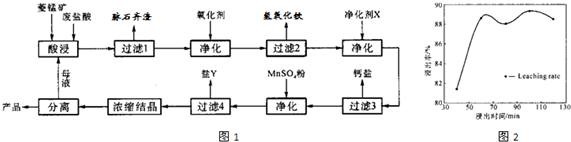
(12分)菱锰矿的主要成分是碳酸锰,还含 Fe2O3、FeO 、CaO、MgO 等成分。某化工厂用废盐酸(质量分数约20%)与菱锰矿制备MnCl2·4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水而成无水物),部分工艺流程如下:
(1)废盐酸与菱镁矿中碳酸锰反应的化学方程式为:_______________________________。
(2)酸浸时,浸出时间对锰浸出率的影响如右图,工业采用的是浸取60min,其可能原因是:____________________________________________________。
(3)图中“净化剂X”可能是________________________。
(4)过滤4获得的盐Y,其主要成分是__________________________。
(5)浓缩结晶时,必须一出现晶膜立刻停止加热,其原因是:_______________________。
查看答案和解析>>
科目:高中化学 来源:2012届江苏省高三高考压轴化学试卷 (带解析) 题型:填空题
(12分)菱锰矿的主要成分是碳酸锰,还含 Fe2O3、FeO、CaO、MgO 等成分。某化工厂用废盐酸(质量分数约20%)与菱锰矿制备MnCl2·4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水而成无水物),部分工艺流程如下: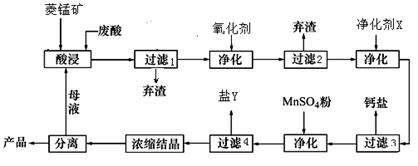
(1)废盐酸与菱镁矿中碳酸锰反应的化学方程式为:_______________________________。
(2)酸浸时,浸出时间对锰浸出率的影响如右图,工业采用的是浸取60min,其可能原因是:____________________________________________________。
(3)图中“净化剂X”可能是________________________。
(4)过滤4获得的盐Y,其主要成分是__________________________。
(5)浓缩结晶时,必须一出现晶膜立刻停止加热,其原因是:_______________________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年江苏省高三高考压轴化学试卷(解析版) 题型:填空题
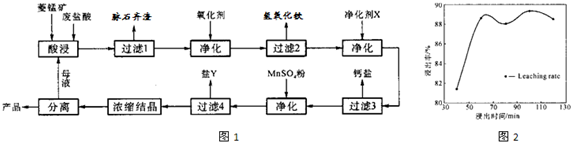
(12分)菱锰矿的主要成分是碳酸锰,还含 Fe2O3、FeO 、CaO、MgO 等成分。某化工厂用废盐酸(质量分数约20%)与菱锰矿制备MnCl2·4H2O(106℃时失去一分子结晶水,198℃时失去全部结晶水而成无水物),部分工艺流程如下:

(1)废盐酸与菱镁矿中碳酸锰反应的化学方程式为:_______________________________。
(2)酸浸时,浸出时间对锰浸出率的影响如右图,工业采用的是浸取60min,其可能原因是:____________________________________________________。
(3)图中“净化剂X”可能是________________________。
(4)过滤4获得的盐Y,其主要成分是__________________________。
(5)浓缩结晶时,必须一出现晶膜立刻停止加热,其原因是:_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com