
| A. | Fe3+、NH4+、Cl-、I- | B. | Cu2+、Na+、Cl-、NO3- | ||
| C. | K+、HCO3-、OH-、Ba2+ | D. | K+、CO32-、NO3-、Al3+ |
 教材全解字词句篇系列答案
教材全解字词句篇系列答案科目:高中化学 来源: 题型:选择题
| A | B | C | D | |
| 物质 |  甘蔗 |  生石灰 |  液氨 |  亚硝酸钠 |
| 用途 | 甘蔗渣可以制得酒精 | 干燥剂、抗氧化剂 | 制冷剂 | 食品防腐剂 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
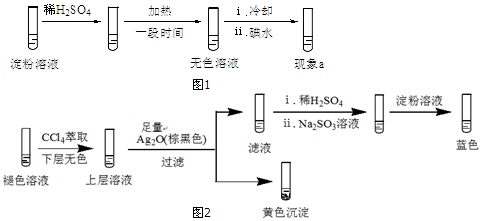
科目:高中化学 来源: 题型:实验题
| 实验A | 条件 | 现象 |
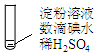 | 加热 | ⅰ.加热后蓝色褪去 ⅱ.冷却过程中,溶液恢复蓝色 ⅲ.一段时间后,蓝色重又褪去 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 酸 | 醋酸 | 次氯酸 | 碳酸 | 亚硫酸 |
| 电离平衡 常数 | Ka=1.75×10-5 | Ka=2.98×10-8 | K1=4.30×10-7 K2=5.61×10-11 | K1=1.54×10-2 K2=1.02×10-7 |
| A. | 将0.1mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小 | |
| B. | 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO | |
| C. | 少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO | |
| D. | 25℃,等浓度的CH3COOH、HClO、H2CO3和H2SO3溶液中,酸性最强的是HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.
下表是元素周期表的一部分,根据表中给出的10种元素,回答下列问题.| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | C | N | O | F | ||||
| 3 | Na | Mg | Al | S | Cl | Ar |
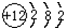 ,其对应的元素符号是Mg;
,其对应的元素符号是Mg;查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验次数 | 称取样品的质量/g | 所加Ba(OH)2溶液的体积/L | 测得生成沉淀的质量/g |
| 1 | 0.518 | 0.5 | 0.985 |
| 2 | 1.036 | 0.5 | 1.970 |
| 3 | 1.554 | 0.5 | 2.955 |
| 4 | 2.072 | 0.5 | 3.940 |
| 5 | 2.590 | 0.5 | 3.940 |
| 6 | 3.108 | 0.5 | 3.940 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol任何粒子的粒子数叫做阿伏伽德罗常数 | |
| B. | 1molH2O中含有3mol原子 | |
| C. | 1molH2O中含有2 mol氢和1mol氧 | |
| D. | 0.012Kg12C中约含有6.02×1023个碳原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com