
100mL 6mol/L H2SO4跟过量锌粉反应,在一定温度,为了“减缓反应进行的速率,但又不影响生成H2的总量”,可向反应物中加入适量的 ( )
A.Na2CO3溶液 B.Na2CO3固体 C.水 D.NaNO3固体
科目:高中化学 来源:2013-2014福建省高二下学期期末考试化学试卷(解析版) 题型:选择题
下列物质的水溶液在适当加热时酸性增强的是
A.氯化铁 B.氯化钠 C.盐酸 D.碳酸钠
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省三明市三校高三下学期联考理综化学试卷(解析版) 题型:选择题
北京2008奥运会金牌直径为70mm,厚6mm。某化学兴趣小组对金牌成分提出猜想:甲认为金牌是由纯金制造;乙认为金牌是由金银合金制成;丙认为金牌是由黄铜(铜锌合金)。为了验证他们的猜想,请你选择一种试剂证明甲、乙、丙猜想的正误
A.硫酸铜溶液 B.盐酸 C. 稀硝酸 D. 硝酸银溶液
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高二化学试卷(解析版) 题型:选择题
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3; ③1s22s22p3; ④1s22s22p5。则下列有关比较中正确的是
A.第一电离能:①>② B.原子半径:④>③
C.电负性: ②>③ D.氢化物稳定性:①>②
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:填空题
硫酸的消费量是衡量一个国家化工生产水平的重要标志。
(1)一定条件下,SO2与空气反应10 min后,SO2和SO3物质的量浓度分别为1.2 mol/L和2.0 mol/L,则SO2起始物质的量浓度为______;生成SO3的化学反应速率为______。
(2)若改变外界条件,发生SO2与空气反应生成SO3,使10 min内的用O2表示的反应速率为0.15mol/(L·min),则改变的条件可能是_______________。
A.压缩体积,增大压强 B.降低温度 C.充入大量的氮气 D.仅增加SO2的浓度
(3)工业制硫酸,用过量的氨水对SO2尾气处理,请写出相关的离子方程式: ____ _
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
下列说法正确的是 ( )
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源:2013-2014福建省“四地六校”下学期第三次联考高一化学试卷(解析版) 题型:选择题
下列化学用语或模型正确的是( )
A.氯化氢的电子式: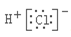 B.N2的结构式:N≡N
B.N2的结构式:N≡N
C.硫离子结构示意图: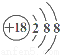 D.CH4分子的球棍模型:
D.CH4分子的球棍模型:
查看答案和解析>>
科目:高中化学 来源:2013-2014福建安溪一中、惠安一中、养正中学下学期期中高二化学(解析版) 题型:选择题
已知氢气在氯气中燃烧时产生苍白色火焰,在反应过程中,破坏1 mol氢气的化学键消耗的能量为Q1 kJ,破坏1 mol氯气的化学键消耗的能量为Q2kJ ,形成1 mol氯化氢中的化学键消耗的能量为Q3kJ,下列关系式正确的是 ( )
A、Q1 + Q2 > Q3 B、Q1 + Q2 > 2Q3 C、Q1 + Q2 < Q3 D、Q1+ Q2 < 2Q3
查看答案和解析>>
科目:高中化学 来源:2013-2014甘肃省高一下学期期末考试化学试卷(解析版) 题型:选择题
列关于同主族元素的说法错误的是( )
A.同主族元素随原子序数递增,元素原子的得电子能力逐渐增强
B. 同主族元素随原子序数递增,单质氧化能力逐渐减弱
C. 同主族元素原子最外层电子数都相同
D. 同主族元素的原子半径,随原子序数增大而逐渐增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com