
对室温下氢离子浓度、体积均相同的HCl溶液和CH3COOH溶液分别采取以下措施,
有关叙述正确的是( )
A.加适量的CH3COONa晶体,两溶液的氢离子浓度减小
B.使温度升高20 ℃,两溶液的氢离子浓度不变
C.加水稀释2倍,两溶液的氢离子浓度增大
D.加足量的Zn充分反应后,两溶液中产生的氢气一样多
A
【解析】醋酸和盐酸的c(H+)相同,CH3COOH溶液中存在着电离平衡:CH3COOH CH3COO-+H+,加入少量CH3COONa晶体,平衡向逆反应方向移动,溶液中c(H+)减小。而盐酸则和CH3COONa反应生成弱电解质CH3COOH,c(H+)减小;升温,促进CH3COOH电离,c(H+)增大,盐酸挥发,溶质减少,c(H+)减小;加水稀释,CH3COOH的电离平衡向正反应方向移动,稀释相同倍数后两溶液的c(H+)不相同,醋酸中的c(H+)大于盐酸中的c(H+),但c(H+)均减小;由于醋酸和盐酸的c(H+)相同,而醋酸为弱酸,所以c(CH3COOH)大于c(HCl),加入足量的锌,由于CH3COOH浓度大,随着反应的进行,CH3COOH继续电离产生H+,因此产生的氢气多。
CH3COO-+H+,加入少量CH3COONa晶体,平衡向逆反应方向移动,溶液中c(H+)减小。而盐酸则和CH3COONa反应生成弱电解质CH3COOH,c(H+)减小;升温,促进CH3COOH电离,c(H+)增大,盐酸挥发,溶质减少,c(H+)减小;加水稀释,CH3COOH的电离平衡向正反应方向移动,稀释相同倍数后两溶液的c(H+)不相同,醋酸中的c(H+)大于盐酸中的c(H+),但c(H+)均减小;由于醋酸和盐酸的c(H+)相同,而醋酸为弱酸,所以c(CH3COOH)大于c(HCl),加入足量的锌,由于CH3COOH浓度大,随着反应的进行,CH3COOH继续电离产生H+,因此产生的氢气多。


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源:2014年高考化学一轮复习课后规范训练9-2练习卷(解析版) 题型:选择题
以铬酸钾为原料,电化学法制备重铬酸钾的实验装置示意图如下:
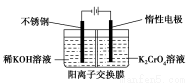
下列说法不正确的是( )
A.在阴极室,发生的电极反应为:2H2O+2e-=2OH-+H2↑
B.在阳极室,通电后溶液逐渐由黄色变为橙色,是因为阳极区H+浓度增大,使平衡2CrO42-+2H+ Cr2O72-+H2O向右移动
Cr2O72-+H2O向右移动
C.该制备过程总反应的化学方程式为:4K2CrO4+4H2O 2K2Cr2O7+4KOH+2H2↑+O2↑
2K2Cr2O7+4KOH+2H2↑+O2↑
D.测定阳极液中K和Cr的含量,若K与Cr的物质的量之比(nk/nCr)为d,则此时铬酸钾的转化率为1-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-3练习卷(解析版) 题型:填空题
根据下列化合物:
①NaCl;②NaOH;③HCl;④NH4Cl;⑤CH3COONa;⑥CH3COOH;⑦NH3·H2O;⑧H2O
回答下列问题。
(1)NH4Cl溶液显 性,用离子方程式表示原因 ,其溶液中离子浓度大小顺序为 。
(2)常温下,pH=11的CH3COONa溶液中,水电离出来的c(OH-)= ,在pH=3的CH3COOH溶液中,水电离出来的c(H+)= 。
(3)已知纯水中存在如下平衡:H2O+H2O H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
H3O++OH- ΔH>0,现欲使平衡向右移动,且所得溶液显酸性,可选择的方法是 (填字母序号)。
A.向水中加入NaHSO4固体
B.向水中加Na2CO3固体
C.加热至100 ℃[其中c(H+)=1×10-6 mol·L-1]
D.向水中加入(NH4)2SO4固体
(4)若将等pH、等体积的②NaOH溶液和⑦NH3·H2O溶液分别加水稀释m倍、n倍,稀释后两种溶液的pH仍相等,则m (填“<”、“>”或“=”)n。
(5)除⑧H2O外,若其余7种物质的溶液的物质的量浓度相同,则这7种物质的溶液按pH由大到小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:选择题
现有pH=5的CH3COOH溶液10 mL,要使其pH增大3,可采取的方法有( )
A.向溶液中加水稀释至10 L
B.加入一定量的NaOH固体
C.加入一定量pH=8的NaOH溶液
D.加入一定浓度的盐酸
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-2练习卷(解析版) 题型:选择题
室温下,水的电离达到平衡:H2O H++OH-。下列叙述正确的是( )
H++OH-。下列叙述正确的是( )
A.将水加热,平衡正向移动,KW变小
B.向水中加入少量NaOH固体,平衡逆向移动,c(OH-)增大
C.新制氯水久置后,水的电离平衡正向移动,c(OH-)增大
D.向水中加入少量CH3COONa固体,平衡正向移动,KW增大
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练8-1练习卷(解析版) 题型:选择题
H2O2是一种二元弱酸,对于0.1 mol·L-1的过氧化氢溶液,下列叙述不正确的是( )
A.H2O2的电离方程式可写作H2O2 H++HO2-,HO2-
H++HO2-,HO2- H++O42-
H++O42-
B.加水稀释过程中,K1(H2O2)增大,α(H2O2)增大,c(H+)增大
C.加入少量浓盐酸,过氧化氢的电离平衡逆向移动,水的电离平衡逆向移动
D.加入少量氯化铁溶液,溶液中产生大量气泡
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-3练习卷(解析版) 题型:填空题
活性炭可用于处理大气污染物NO。在1 L密闭容器中加入NO和
活性炭(无杂质),生成气体E和F。当温度分别在T1 ℃和T2 ℃时,测得平衡时各物质的物质的量如下表:
物质 n/mol T/℃ | 活性炭 | NO | E | F |
初始 | 2.030 | 0.100 | 0 | 0 |
T1 | 2.000 | 0.040 | 0.030 | 0.030 |
T2 | 2.005 | 0.050 | 0.025 | 0.025 |
(1)请结合上表数据,写出NO与活性炭反应的化学方程式: 。
(2)上述反应在T1 ℃时的平衡常数为K1,在T2 ℃时的平衡常数为K2。
①计算K1= 。
②根据上述信息判断,T1和T2的关系是 (填序号)。
a.T1>T2 b.T1<T2 c.无法比较
(3)在T1 ℃下反应达到平衡后,下列措施不能改变NO的转化率的是 (填序号)。
a.增大c(NO) b.增大压强
c.升高温度 d.移去部分F
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练7-2练习卷(解析版) 题型:选择题
在密闭的容积可变的容器中通入A、B两种气体,在一定条件下反应:2A(g)+B(g)  2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
2C(g) ΔH<0。达到平衡后,改变一个条件,下列量(Y)的变化不符合图中曲线的是( )
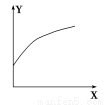
XY
A再加入AB的转化率
B降低温度混合气体的密度
C增大压强A的转化率
D升高温度混合气体的平均摩尔质量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学一轮复习课后规范训练5-3练习卷(解析版) 题型:选择题
固体A的化学式为NH5,它的所有原子的最外层都符合相应稀有气体原子的电子层结构,
电子式如图所示: ,下列说法正确的是( )
,下列说法正确的是( )
A.NH5属于离子化合物
B.NH5属于共价化合物
C.NH5只含有离子键
D.NH5只含有共价键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com