
【题目】短周期元素A、B、C、D、E原子序数依次增大。A是周期表中原子半径最小的元素,B原子的最外层电子数等于该元素最低化合价的绝对值,C与D能形成D2C和D2C2两种化合物,而D是同周期中金属性最强的元素,E的负一价离子与C和A形成的某种化合物分子含有相同的电子数。
(1)A、C、D形成的化合物中含有的化学键类型为___________________;
(2)已知:①E-E→2E;△H=+a kJmol-1
②2A→A-A;△H=-b kJmol-1
③E+A→A-E;△H=-c kJmol-1(“”表示形成共价键所提供的电子)
写出298K时,A2与E2反应的热化学方程式___________________;
(3)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2A2(g)+BC(g)X(g);△H=-d Jmol-1(d>0,X为A、B、C三种元素组成的一种化合物).初始投料与各容器达到平衡时的有关数据如下:
实验 | 甲 | 乙 | 丙 |
初始投料 | 2mol A2、1mol BC | 1mol X | 4mol A2、2mol BC |
平衡时n(X) | 0.5mol | n2 | n3 |
反应的能量变化 | 放出Q1kJ | 吸收Q2kJ | 放出Q3kJ |
体系的压强 | P1 | P2 | P3 |
反应物的转化率 | α1 | α2 | α3 |
①该温度下此反应的平衡常数K的值为_____;
②三个容器中的反应分别达平衡时各组数据关系正确的是_____(填序号)
A.α1+α2=1 B.α3<α1 C.n2<n3<1.0mol D.P3<2P1=2P2 E.Q1+Q2=d F.Q3=2Q1
(4)在其他条件不变的情况下,将甲容器的体系体积压缩到1L,若在第8min达到新的平衡时A2的总转化率为65.5%,请在下图中画出第5min到新平衡时X的物质的量浓度的变化曲线。

【答案】(1)离子键、共价键 (2)H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJmol-1
(3)① 4 ②ADE (4)
【解析】
试题分析:短周期元素A、B、C、D、E原子序数依次增大,A是周期表中原子半径最小的元素,则A为氢元素;D是同周期中金属性最强的元素,处于ⅠA族,D的原子序数比H元素至少大3,可推知D为Na元素;B原子的价电子数等于该元素最低化合价的绝对值,处于ⅣA族,结合原子序数可知,B为碳元素;C与D能形成D2C和D2C2两种化合物,则C为O元素;E形成负一价离子,则E为Cl,氯离子与H2O2含有相同的电子数;(1)A、C、D形成的化合物为NaOH,属于离子化合物,氢氧根离子中氧原子与氢原子之间形成共价键,故含有离子键、共价键;(2)已知:①Cl-Cl→2Cl;△H=+a kJmol-1 ②2H→H-H;△H=-b kJmol-1 ③Cl+H→H-Cl;△H=-c kJmol-1, 根据盖斯定律,①-②+③×2得:H2(g)+Cl2(g)=2HCl(g)△H=(a+b-2c) kJmol-1;(3)①CO的起始浓度=![]() =0.5mol/L,氢气的起始浓度=
=0.5mol/L,氢气的起始浓度=![]() =1mol/L,达到平衡时c(CH3OH)=
=1mol/L,达到平衡时c(CH3OH)=![]() =0.25mol/L,则:
=0.25mol/L,则:
CO(g)+2H2(g)CH3OH(g)
起始(mol/L):0.5 1 0
变化(mol/L):0.25 0.5 0.25
平衡(mol/L):0.25 0.5 0.25
所以:平衡常数k═![]() =4;
=4;
②A.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为amol,甲中CO转化率α1=![]() =1-a,平衡时甲醇的物质的量=(1-a)mol,乙中参加反应的甲醇为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;B.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应方向移动,转化率增大,即α3>α1 ,故B错误;C.由D中分析可知,n2=0.5,n3>1.0mol,故C错误;D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强等效,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2 ,故D正确;E.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为bmol,则甲中参加反应的CO为(1-b)mol,放出的热量Q1=d(1-b),乙中参加反应的甲醇为bmol,吸收的热量Q2=bd,故Q1+Q2=d(1-b)+bd=d,故E正确;F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的CO的物质的量大于甲中的2倍,则Q3>2Q1,故F错误,故答案为ADE。
=1-a,平衡时甲醇的物质的量=(1-a)mol,乙中参加反应的甲醇为amol,乙中的转化率α2=a,故α1+α2=1,故A正确;B.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应方向移动,转化率增大,即α3>α1 ,故B错误;C.由D中分析可知,n2=0.5,n3>1.0mol,故C错误;D.甲、乙为等效平衡,平衡时对应各组分的物质的量相等,二者压强等效,丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,平衡时混合气体的物质的量小于甲中的2倍,故压强P3<2P1=2P2 ,故D正确;E.甲、乙为等效平衡,平衡时CO的物质的量相等,令平衡时CO为bmol,则甲中参加反应的CO为(1-b)mol,放出的热量Q1=d(1-b),乙中参加反应的甲醇为bmol,吸收的热量Q2=bd,故Q1+Q2=d(1-b)+bd=d,故E正确;F.丙与甲相比,可以等效为在甲的基础上,压强增大一倍,平衡向正反应移动,丙中参加反应的CO的物质的量大于甲中的2倍,则Q3>2Q1,故F错误,故答案为ADE。
(4)将甲容器的体系体积压缩到1L,若在第8min 达到新的平衡时,
2H2(g)+CO(g)CH4O(g)
初始量:2 1 0
变化量:1.31 0.655 0.655
平衡量:0.69 0.345 0.655
所以达到平衡时,甲醇的物质的量浓度是0.655mol/L,在第5min时,由于体积减半,所以甲醇的浓度
应该加倍,即为0.25mol/L×2=0.5mol/L,所以5-8min内,甲醇的物质的量浓度从0.5mol/L升高到0.655mol/L,如图所示: 。
。


 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案科目:高中化学 来源: 题型:
【题目】在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如下图所示。 又知AgCl的Ksp=1.8×10-10。下列说法正确的是( )
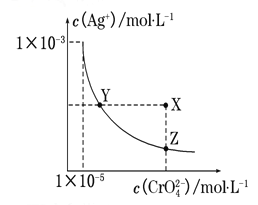
A.t℃时,Ag2CrO4的Ksp为1×10-8
B.在饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为X点
C.t℃时,Y点和Z点时Ag2CrO4的Ksp相等
D.t℃时,将0.01 mol·L-1 AgNO3溶液滴入20 mL 0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期原子序数依次增大的六种元素A、B、C、D、E、F中,A+无电子,B的最简单气态氢化物能引起温室效应,D原子核外电子有8种不同的运动状态, E是用途最广泛的金属,F元素的基态原子最外能层只有一个电子,其它能层均已充满电子。
(1)E元素在周期表中的位置 ;F+的电子排布式为 。
(2)化合物BD(CA2)2中,B原子的杂化方式为 ,1mol该分子中σ键数目为 个,该物质易溶于水的主要原因是 _ _____________。
(3)ACD3中阴离子CD3-的空间构型为 ,ACD3酸性比ACD2强,原因是___________。
(4)根据等电子体原理,BD分子的电子式为 ,E与BD形成的化合物E(BD)5熔点253K,沸点376K,其固体属于 晶体。
(5)3g B2A6在足量氧气中燃烧并恢复到室温,放出Q kJ热量,则表示B2A6燃烧热的热化学方程式为
______ _ _____________。
(6)将F单质粉末加入到CA3的浓溶液中,并通入D2,充分反应后溶液呈深蓝色,写出该反应的化学方程式 _ _____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以苯甲醛为原料制备间溴苯甲醛(实验装置见下图,相关物质的物理性质见附表)。
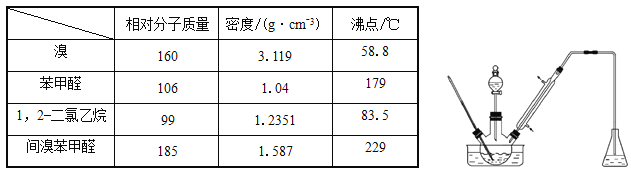
其实验步骤为:
步骤1:将三颈瓶中的一定配比的无水AlCl3、1,2-二氯乙烷和苯甲醛(5.3g)充分混合后,升温至60℃,缓慢滴加经浓硫酸干燥过的液溴,保温反应一段时间,冷却。
步骤2:将反应混合物缓慢加入一定量的稀盐酸中,搅拌、静置、分液。有机相用10%NaHCO3溶液洗涤。
步骤3:经洗涤的有机相加入适量无水硫酸钙固体,放置一段时间后过滤。
步骤4:为了防止间溴苯甲醛因温度过高被氧化,把步骤3处理得到的间溴苯甲醛加入少量锌粉,同时采用某种技术,收集相应馏分,其中收集到间溴苯甲醛为3.7g 。
(1)实验装置中采用的加热方式为_______,冷凝管的作用为_______,锥形瓶中的试剂应为________。
(2)步骤1所加入的无水AlCl3的作用为_________。
(3)步骤2中用10%NaHCO3溶液洗涤有机相,是为了除去溶于有机相的______(填化学式)。
(4)步骤3中加入的无水硫酸钙固体的目的是_______________。
(5)步骤4中,某种技术为__________________。
(6)本实验所得到的间溴苯甲醛产率是_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答以下问题:
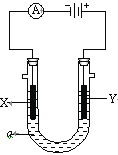
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
① 电解池中X极上的电极反应式为 。在X极附近观察到的现象是 。
② Y电极上的电极反应式为 ,检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,
① X电极的材料是 ,电极反应式是 。
② Y电极的材料是 ,电极反应式是 。(说明:杂质发生的电极反应不必写出)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工业生产和国防建设中有广泛应用。回答下列问题:
(1)氮气性质稳定,可用作保护气。请用电子式表示氮气的形成过程:
。
(2)联氨(N2H4)是一种还原剂。已知:H2O(l)=H2O(g) △H=+44kJ/mol。试结合下表数据,写出N2H4 (g)燃烧热的热化学方程式: 。
化学键 | N—H | N—N | N=N | N≡N | O=O | O—H |
键能(kJ/mol) | 390.8 | 193 | 418 | 946 | 497.3 | 462.8 |
(3)KCN可用于溶解难溶金属卤化物。将AgI溶于KCN溶液中,形成稳定的Ag(CN)2—,该转化的离子方程式为: 。若已知Ksp(AgI)=1.5×10—16,K稳[Ag(CN)2—]=1.0×10-21,则上述转化方程式的平衡常数K= 。(提示:K稳越大,表示该化合物越稳定)
(4)氨的催化氧化用于工业生产硝酸。该反应可设计成新型电池,试写出碱性环境下,该电池的负极电极反应式: 。
(5)将某浓度的NO2气体充入一恒容绝热容器中,发生反应2NO2![]()
![]() N2O4其相关图像如下。
N2O4其相关图像如下。

①0~3s时v(NO2)增大的原因是 。
②5s时NO2转化率为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锌可作为食品锌强化剂的原料。工业上常用菱锌矿生产硫酸锌,菱锌矿的主要成分是ZnCO3,并含少量的Fe2O3、FeCO3MgO、CaO等,生产工艺流程图如下:

(1)将菱锌矿研磨成粉的目的是_____。
(2)完成“氧化除铁”步骤中反应的离子方程式:□Fe(OH)2+□____+□_____=□Fe(OH)3+□CI-
(3)针铁矿(Goethite)是以德国诗人歌德(Goethe)名字命名的,组成元素是Fe、O和H,摩尔质量为89g/mol,化学式是_______。以Al和NiO(OH)为电极,NaOH溶液为电解液组成一种新型电池,放电时针铁矿转化为Fe(OH)2,该电池放电反应的化学方程式是__________。
(4)根据下表数据,调节“滤液2”的pH时,理论上可选用的最大区间为______。
沉淀化学式 | Mg(OH)2 | Zn(OH)2 | MgCO3 | CaCO3 |
开始沉淀的pH | 10.4 | 6.4 | — | — |
沉淀完全的pH | 12.4 | 8.0 | — | — |
开始溶解的pH | — | 10.5 | — | — |
Ksp | 5.6× | — | 6.8× | 2.8× |
(5)工业上从“滤液3”制取MgO过程中,合适的反应物是______(选填序号)。
a.大理石粉 b.石灰乳 c.纯碱溶液 d.氨水
(6)“滤液4”之后的操作依次为______、_______、过滤,洗涤,干燥。
(7)分析图中数据,菱锌矿粉中ZnCO3的质量分数不低于________(用代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10,下列说法不正确的是

A. 在t℃时,AgBr的Ksp为4.9×10-13
B. 在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C. 图中a点对应的是AgBr的不饱和溶液
D. 在t℃时,AgCl(s)+Br-(aq)![]() AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E 5种元素,它们的核电荷数依次增大,且都小于20。其中C、E是金属元素;A和E属同一族,它们原子的最外层电子排布为ns1。B和D也属同一族,它们原子最外层的p能级电子数是s能级电子数的两倍,C原子最外层上电子数等于D原子最外层上电子数的一半。请回答下列问题:
(1)由这五种元素组成的一种化合物是(写化学式)________________________。
(2)写出C元素基态原子的电子排布式_________________________。
(3)用轨道表示式表示D元素原子的价电子构型____________________。
(4)元素B与D的电负性的大小关系是___________,C与E的第一电离能的大小关系是___________。(填﹥、﹤、﹦,并且用元素符号表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com