
某温度下,体积一定的密闭容器中进行如下可逆反应:
X(g)+Y(g) 
 Z(g)+W(g);ΔH>0
Z(g)+W(g);ΔH>0
下列叙述正确的是
A.加入少量W,逆反应速率增大
B.当容器中气体压强不变时,反应达到平衡
C.升高温度,平衡逆向移动
D.平衡后加入X,上述反应的ΔH增大
科目:高中化学 来源: 题型:
CO2的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰酸的反应:
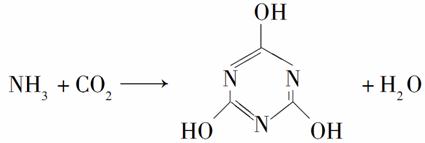
下列有关三聚氰酸的说法正确的是( )
A.分子式为C3H6N3O3
B.分子中既含极性键,又含非极性键
C .属于共价化合物
.属于共价化合物
D.生成该物质的上述反应为中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
2013年初,雾霾天气多次肆虐我
国中东部地区。其中,汽车尾气和燃煤尾气是造成空气污染的原因之一。
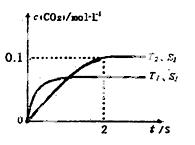
(l)汽车尾气净化的主要原理为: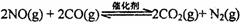 。 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。据此判断:
。 在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如右图所示。据此判断:
①该反应的ΔH______0(选填“>”、“<”)。
②该反应的平衡常数表达式为____________________
③在T2温度下,0 ~ 2s内的平均反应速率v(N2)_______。
④当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面 积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
积S1>S2,在上图中画出c(CO2)在T1、S2条件下达到平衡过程中的变化曲线。
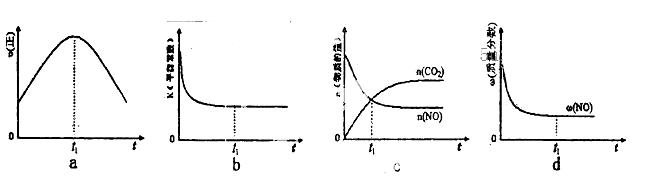
⑤该反应在绝热、恒容的密闭体系中进行,下列示意图正确且能说明反应在进行到t1时刻达到平衡状态的是__________(填代号)。
(2)直接排放煤燃烧产生的烟气会引起严重的环境问题。煤燃烧产生的烟气含氮的氧化物,用CH4催化还原NOx可以消除氮氧化物的污染。例如:
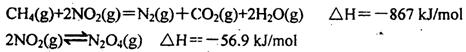
写出CH4催化还原N2O4(g)生成N2(g)、CO2(g)和H2O(g)的热化学方程式______
查看答案和解析>>
科目:高中化学 来源: 题型:
 向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)
向某密闭容器中充入1 mol CO和2 mol H2O(g),发生反应:CO+H2O(g)  CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
CO2+H2。当反应达到平衡时,CO的体积分数为x。若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达到平衡时CO的体积分数大于x的是
A.0.5 mol CO+2 mol H2O(g)+1 mol CO2+1 mol H2
mol CO2+1 mol H2
B.1 mol CO+1 mol H2O(g)+1 mol CO2+1 mol H2
C.0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2
D.0.5 mol CO+1.5 mol H2O(g)+0.5 mol CO2+0.5 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在300 mL的密闭容器中,放入镍粉并充入一定量的CO气体,一定条件下发生反应:Ni(s)+4CO(g)  Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
Ni(CO)4(g),已知该反应的平衡常数与温度的关系如下表:
| 温度/℃ | 25 | 80 | 230 |
| 平衡常数 | 5×104 | 2 | 1.9×10-5 |
下列说法不正确的是 ( )
A.上述生成Ni(CO)4的反应为放热反应
B.25 ℃时反应Ni(CO)4(g)  Ni(s)+4CO(g)的平衡常数为2×10
Ni(s)+4CO(g)的平衡常数为2×10 -5
-5
C.在80 ℃时,测得某时刻Ni(CO)4、CO的浓度均为0.5 mol·L-1,则此时v正>v逆
D.80 ℃达到平衡时,测得n(CO)=0.3 mol,则Ni(CO)4的平衡浓度为2 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
在10L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) M(g)
M(g)
+N(g),所得实验数据如下表:
| 实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | |
| n(X) | n(Y) | n(M) | ||
| ① | 700 | 0.40 | 0.10 | 0.090 |
| ② | 800 | 0.10 | 0.40 | 0.080 |
| ③ | 800 | 0.20 | 0.30 | a |
| ④ | 900 | 0.10 | 0.15 | b |
下列说法正确的是
A.实验①中,若5min时测得n(M)=0.050mol,则0至5min时间内,用N表示的平均反应速率υ(N)=1.0×10-2mol/(L·min)
B.实验②中,该反应的平衡常数K=2.0
C.实验③中,达到平衡是,X的转化率为60%
D.实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
已知A(g)+B(g)C(g)+D(g)反应的平衡常数和温度的关系如下:
| 温度/℃ | 700 | 900 | 830 | 1 000 | 1 200 |
| 平衡常数 | 1.7 | 1.1 | 1.0 | 0.6 | 0.4 |
回答下列问题:
(1)该反应的平衡常数表达式K=__________,ΔH______0(填“<”、“>”或“=”);
(2)830 ℃时,向一个5 L的密闭容器中充入0.20 mol的A和0.80 mol的B,如反应初始6 s内A的平均反应速率v(A)=0.003 mol·L-1·s-1。则6 s时c(A)=________mol·L-1,C的物质的量为________mol;若反应经一段时间后,达到平衡时A的转化率为________,如果这时向该密闭容器中再充入1 mol氩气,平衡时A的转化率为__________;
(3)1 200 ℃时反应C(g)+D(g)  A(g)+B(g)的平衡常数的值为__________。
A(g)+B(g)的平衡常数的值为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
某研究性学习小组在网上收集到如下信息:Fe(NO3)3溶液可以蚀刻银,制作美丽的银饰。他们对饰刻银的原因进行了如下探究:
【实验】
制备银镜,并与Fe(NO3)3溶液反应,发现银镜溶解。
(1)下列有关制备银镜过程的说法正确的是 。
a.边振荡盛有2%的AgNO3溶液的试管,边滴入2%的氨水,至最初的沉淀恰好溶解为止
b.将几滴银氨溶液滴入2 mL乙醛中
c.制备银镜时,用酒精灯的外焰给试管底部加热
d.银氨溶液具有较弱的氧化性
e.在银氨溶液配制过程中,溶液的pH增大
【提出假设】
假设1:Fe3+具有氧化性,能氧化Ag。
假设2:Fe(NO3)3溶液显酸性,在此酸性条件下NO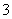 能氧化Ag。
能氧化Ag。
【设计实验方案,验证假设】
(2)甲同学从上述实验的生成物中检验出Fe2+,验证了假设1成立。请写出Fe3+氧化Ag的离子方程式:________。
(3)乙同学设计实验验证假设2,请帮他完成下表中内容(提示:NO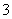 在不同条件下的还原产物较复杂,有时难以观察到气体产生)。
在不同条件下的还原产物较复杂,有时难以观察到气体产生)。

【思考与交流】
(4)甲同学验证了假设1成立,若乙同学验证了假设2也成立,则丙同学由此得出结论:Fe(NO3)3溶液中的Fe3+和NO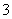 都氧化了Ag。
都氧化了Ag。
你是否同意丙同学的结论,并简述理由:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
FeCl3(aq)与KSCN(aq)混合时存在下列平衡:
Fe3+(aq)+SCN-(aq) 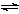 Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
Fe(SCN)2+(aq)。已知平衡时,物质的量浓度c[Fe(SCN)2+]与温度T的关系如图所示,则下列说法正确的是
A.FeCl3(aq)与KSCN(aq)反应的热化学反应方程式为
Fe3+(aq)+SCN—(aq) 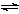 Fe(SCN)2+(aq) ΔH >0
Fe(SCN)2+(aq) ΔH >0
B.温度为T1、T2时,反应的平衡常数分别为K1、K2,则K1<K2
C.反应处于D点时,一定有υ正>υ逆
D.A点与B点相比,A点的c(Fe3+)大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com