
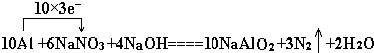
分析 (1)10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O中,Al元素的化合价升高,N元素的化合价降低,该反应中转移30e-;
(2)①氯气通入石灰乳[Ca(OH)2],反应生成氯化钙、次氯酸钙、水;
②漂白粉的有效成分为次氯酸钙;
③漂白粉溶于水后,与CO2、水反应生成碳酸钙和次氯酸.
解答 解:(1)①Al元素的化合价由0升高为+3价,失去电子,故答案为:Al;失去;
②10Al+6NaNO3+4NaOH═10NaAlO2+3N2↑+2H2O中,Al元素的化合价升高,N元素的化合价降低,该反应中转移30e-,用“单线桥法”表示反应中电子转移的方向和数目为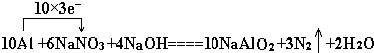 ,
,
故答案为: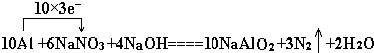 ;
;
(2)①氯气通入石灰乳[Ca(OH)2],反应生成氯化钙、次氯酸钙、水,反应为2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O,
故答案为:2Ca(OH)2+2Cl2═CaCl2+Ca(ClO)2+2H2O;
②漂白粉的有效成分为Ca(ClO)2,故答案为:Ca(ClO)2;
③漂白粉溶于水后,与CO2、水反应生成碳酸钙和次氯酸,离子反应为Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO,故答案为:Ca2++2ClO-+CO2+H2O═CaCO3↓+2HClO.
点评 本题考查氧化还原反应,为高频考点,把握发生的反应及反应中元素的化合价变化为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
| 化学键 | C-C | C-H | C-O | Si-Si | Si-H | Si-O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.
在实验室里制取乙烯,常因温度过高而使乙醇和浓硫酸反应生成少量的二氧化硫,有人设计了下列实验图以确认上述混合气体中有CH2=CH2和SO2.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过氧化钠、纯碱分别属于碱性氧化物、碱 | |
| B. | NO、NO2 都是大气污染物,在空气中都能稳定存在 | |
| C. | SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物 | |
| D. | 检验某浅绿色溶液中含有Fe2+:取该溶液少许,向其中加入KSCN溶液,不变红色,再向其中滴加氯水,溶液变为红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用激光笔分别照射盛有牛奶、食盐水的玻璃杯,都有光亮的通路 | |
| B. | 神舟10号飞船所用太阳能电池板可将光能转换为电能,转换材料是二氧化硅 | |
| C. | 氯气溶于水生成次氯酸有强氧化性,可以起到除去水中杂质和杀菌消毒作用 | |
| D. | 可以用物理方法或化学方法从海水中提取所需物质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 磁性氧化铁溶于稀硝酸:3Fe2++4H++NO3-═3Fe3++NO↑+3H2O | |
| B. | 向NaAlO2溶液中通入过量CO2制Al(OH)3:AlO2-+CO2+2H2O═Al(OH)3↓+HCO3- | |
| C. | 用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O | |
| D. | 在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3═2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 仅②④⑤ | B. | 仅①③④ | C. | 仅①②③④ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 地下钢管连接镁块 | B. | 金属护栏表面涂漆 | ||
| C. | 汽车底盘喷涂高分子膜 | D. | 水中的钢闸门连接电源的负极 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com