
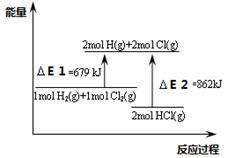
| A.△E2是2mol HCl(g)的总键能 |
| B.该反应的热化学方程式为:H2(g)+Cl2(g)=2HCl(g)△H =-183KJ.mol-1 |
| C.通常情况下H2与Cl2混和不会反应 |
| D.该反应是一个吸热反应 |
科目:高中化学 来源:不详 题型:填空题

 O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。
O2(g)=CO(g)的ΔH。但可设计实验、利用盖斯定律计算出该反应的ΔH,计算时需要测得的实验数据有________。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题



查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 共价键 | H-H | F-F | H-F | H-Cl | H-I |
| E(kJ·mol-1) | 436 | 157 | 568 | 432 | 298 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:
2SO3(g) △H =" a" kJ·mol-1,反应过程的能量变化如图所示。已知1mol SO2(g)完全转化为1mol SO3(g)放热99 kJ。请回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )
2NH3(g)△H=" —92" kJ/mol,相关数据如下表。一定条件下,在体积为1L的密闭容器中加入1molN2和3molH2充分反应,放出热量Q1kJ,下列说法正确的是( )| | H2(g) | N2(g) | NH3(g) |
| 1mol分子中的化学键形成时要释放出的能量/kJ | 436 | 946 | a |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com