
【题目】如图为某学习小组设计的制取乙酸乙酯的改进装置,其实验过程如下,请回答相关问题。
(1)按如图所示组装好仪器后,首先进行的操作是 。
(2)在带刻度的试管中加入一滴1%的酚酞溶液和足量的饱和碳酸钠溶液, 并将其固定在铁架台上。请问饱和碳酸钠溶液的作用是 。
(3)在烧瓶中加入①5 mL 37%的醋酸、②2 mL酒精和③2 mL浓硫酸以及几粒沸石。请问加入三种液体的顺序是 (请填序号)。加入几粒沸石的作用是 。
(4)圆底烧瓶中发生反应的化学方程式为: 。
(5)把干燥管处的塞子打开,停止加热,撤掉干燥管,可看到试管中呈现两层不同颜色的液体,上层液体 色。
【答案】(1)检查装置气密性(2分)
(2)吸收挥发出来的乙醇,中和乙酸和降低乙酸乙酯在水中的溶解度(2分)
(3) ②③①(2分)防止加热时溶液暴沸(2分)
(4) CH3CH2OH+CH3COOH![]() CH3COOCH2CH3 + H2O (3分)
CH3COOCH2CH3 + H2O (3分)
(5)无 (2分)
【解析】
试题分析:(1)组装好仪器后应先检查装置气密性。(2)饱和碳酸钠溶液的作用为吸收挥发出来的乙醇,中和乙酸和降低乙酸乙酯在水中的溶解度。(3)因为浓硫酸与溶液混合会放出热量,造成乙酸或乙醇的挥发,一般实验中乙醇是过量的,所以先加入酒精,再加入浓硫酸,最后加入乙酸,顺序为: ②③①。加入沸石是为了防止加热时溶液暴沸。(4) 乙酸和乙醇在浓硫酸加热的条件下反应生成乙酸乙酯和水,方程式为:CH3CH2OH+CH3COOH ![]() CH3COOCH2CH3 + H2O。(5)乙酸乙酯的密度比水小,不溶于水,所以上层为乙酸乙酯,无色。
CH3COOCH2CH3 + H2O。(5)乙酸乙酯的密度比水小,不溶于水,所以上层为乙酸乙酯,无色。


 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:
【题目】Y元素最高正价与最低负价的绝对值之差是4;Y元素与M元素形成离子化合物,并在水中电离出电子层结构相同的离子,该化合物是( )
A. KCl B. Na2S C. Na2O D. K2S
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2、CO、NO都是常见的大气污染物。
(1)工业上常用SO2除去CO,生成物为S和CO2。已知:S(s)+O2(g)=SO2(g) ![]() H=a kJmol-1
H=a kJmol-1
CO(g)+ ![]() O2(g)=CO2(g)
O2(g)=CO2(g) ![]() H=b kJmol-1则反应SO2(g)+2CO(g)=S(s)+2CO2(g)的
H=b kJmol-1则反应SO2(g)+2CO(g)=S(s)+2CO2(g)的![]() H= kJmol-1。
H= kJmol-1。
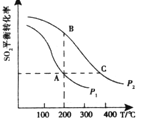
(2)在其他条件相同的密闭容器中发生反应:2SO2(g)+O2(g)![]() 2SO3(g),分别测得SO2的平衡转化率在不同压强和温度下的变化曲线如右图所示。则:①A、B两点对应的反应速率:
2SO3(g),分别测得SO2的平衡转化率在不同压强和温度下的变化曲线如右图所示。则:①A、B两点对应的反应速率:![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
②B、C两点对应的化学平衡常数:![]() (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。
(3)25℃时,用100mL0.1mol·L-1的NaOH溶液吸收SO2。当溶液中![]() 时,溶液显_______性(填“酸”、“中”或“碱”),溶液中
时,溶液显_______性(填“酸”、“中”或“碱”),溶液中![]() __________mol·L-1。(已知:H2SO3的电离平衡常数Kal=1×10-2mol·L-1,Ka2=2×10-7mol·L-1)
__________mol·L-1。(已知:H2SO3的电离平衡常数Kal=1×10-2mol·L-1,Ka2=2×10-7mol·L-1)
(4)电解NO2制备NH4NO3,其工作原理如下图所示。

①阳极电极反应式为________________________。
②为使电解产物全部转化为NH4NO3,需补充物质A,则A的化学式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于化学键的下列叙述中,正确的是( )
A.离子化合物可能含共价键
B.共价化合物可能含离子键
C.离子化合物中只含离子键
D.共价化合物中可能含共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
据此回答以下问题:
(1)①该反应的化学平衡常数表达式为K=________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越________。
(2)某温度下,若把1 mol N2与3 mol H2置于体积为1L的密闭容器内,反应达到平衡状态时,测得混合气体中氨的体积分数为1/3,则该温度下反应的K的计算式=________(用分数表示)。能说明该反应达到化学平衡状态的是________(填字母)。
a.容器内的密度保持不变
b.容器内压强保持不变
c.v正(N2)=2v逆(NH3)
d.混合气体中c(NH3)不变
(3)对于合成氨反应而言,下列有关图像一定正确的是(选填序号)________。

(4)相同温度下,有恒容密闭容器A和恒压密闭容器B,两容器中均充入1 mol N2和3 mol H2,此时两容器的体积相等。在一定条件下反应达到平衡状态,A中NH3的体积分数为a,放出热量Q1 kJ;B中NH3的体积分数为b,放出热量Q2 kJ。则:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1________92.4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液由K+、Cu2+、Ca2+、Al3+、AlO2-、CO32-、SO42-、Cl-中的若干种离子组成,取适量该溶液进行如下实验:
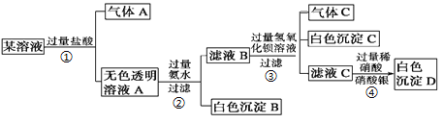
根据上述实验回答下列问题:
(1)写出气体A的电子式 ,气体C的结构式 。
(2)写出过程①中的离子方程式 、 。
(3)根据上述实验 (填“能”或“不能”)确定原溶液中存在K+,说明理由 ;过程④中的现象 (填“能”或“不能”)证明原溶液中存在Cl-,说明理由 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一个简易测量物质反应是吸热还是放热的实验装置,利用此装置可以很方便地测得某反应是放热反应还是吸热反应。请根据装置回答下列问题:

(1)将铝片加入小试管内,然后注入足量的盐酸,有关反应的离子方程式是_____________________,试管中看到的现象是_______________________。
(2)弯管中A端液面________(填“上升”或“下降”),原因是_________________;说明此反应是________(填“放热”或“吸热”)反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质用途的说法不符合事实的是
A.SO2可用于杀菌、消毒 B.HF可用于雕刻玻璃
C.NH3可用于制硝酸 D.SiO2可用于制太阳能电池
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】注射用双黄连以绿原酸为主要成分(其结构如右图), 。绿原酸有广泛的药理作用。
。绿原酸有广泛的药理作用。
已知一个绿原酸分子在酸性条件水解得到一个咖啡酸A分子(环上有3个取代基)和一个奎尼酸分子,某小组对A的研究如下:

(1)咖啡酸A分子中含有的官能团为 (写名称);奎尼酸的结构简式为 ;
(2)反应①的反应类型为 ;
(3)反应②中1 mol B生成1mol C需NaOH的物质的量 ;
(4)写出A生成B的化学方程式 ;
(5)写出符合下列4个条件的A的所有同分异构体的结构简式 ;
①遇FeCl3溶液显色;
②1 mol E能消耗2 mol Na或1 mol NaOH;
③l mol E与足量新制Cu(OH)2反应生成2 mol Cu2O;
④苯环上只有一种化学环境的氢。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com