
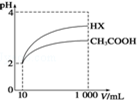
 25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��
25��ʱ���������ʵĵ���ƽ�ⳣ�������ʾ��| ��ѧʽ | CH3COOH | H2CO3 | HClO |
| ����ƽ�ⳣ�� | 1.7��10-5 | K1=4.3��10-7��K2=5.6��10-11 | 3.0��10-8 |
���� ��1������ƽ�ⳣ��Խ����ĵ���̶�Խ����Һ����Խǿ��
��2��������Ӷ�Ӧ�����ĵ���ƽ�ⳣ��Խ������������������Խ����
��3��CH3COOH��Һ��ˮϡ�����У�����ĵ���̶�����������Ũ�ȡ����������Ũ�ȼ�С��������������Ũ�����������¶Ȳ��䣬�����ƽ�ⳣ����ˮ�����ӻ����䣻�����¶Ⱥ����ĵ���̶���������Һ��������Ũ������ˮ�����ӻ�������ƽ�ⳣ������
��4����ͼ��֪��ϡ����ͬ�ı�����HX��pH�仯�̶ȴ�������HXǿ������ƽ�ⳣ����ϡ�ͺ�HX�������ɵ�c��H+��С����ˮ�ĵ�����������С��
��� �⣺��1�����ݱ������ݿ�֪����ĵ����ƽ�ⳣ����СΪ��CH3COOH��H2CO3��HCO3-��HClO������ƽ�ⳣ��Խ������Խǿ������������ǿ������˳��ΪΪ��CH3COOH��H2CO3��HClO��
�ʴ�Ϊ��CH3COOH��H2CO3��HClO��
��2��������Ӷ�Ӧ�����ĵ���ƽ�ⳣ��Խ������������������Խ�������ڵ���ƽ�ⳣ��CH3COOH��H2CO3��HCO3-��HClO����ͬŨ��CH3COO-��HCO3-��CO32-��ClO-���H+��������ǿ������˳��Ϊ��CO32-��ClO-��HCO3-��CH3COO-��
�ʴ�Ϊ��CO32-��ClO-��HCO3-��CH3COO-��
��3��A.0.1mol•L-1��CH3COOH��Һ��ϡ�����У���Һ��������Ũ�ȼ�С����A��ȷ��
B.0.1mol•L-1��CH3COOH��Һ��ϡ�����У�������Ũ�ȼ�С��ͬʱ����ĵ��������ƶ���c��H+����С�ij̶�С��c��CH3COOH���ļ�С�̶ȣ���$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$����B����
C��Kw=c��H+��•c��OH-��ֻ���¶ȵ�Ӱ�죬�¶Ȳ�������ֵ��һ����������C����
D������ϡ�ͣ����Լ�����c��H+����С��ˮ�����ӻ����䣬��c��OH-����������$\frac{c��O{H}^{-}��}{c��{H}^{+}��}$����D����
E.$\frac{c��C{H}_{3}CO{O}^{-}��c��{H}^{+}��}{c��C{H}_{3}COOH��}$Ϊ����ĵ���ƽ�ⳣ���������¶Ȳ��䣬��ˮ�ĵ���ƽ�ⳣ�����䣬��E����ѡA��
������Һ�����¶ȣ����ᡢˮ�ĵ���̶ȶ���������Һ�������ӡ�����������Ũ�ȶ�����
A�������¶Ⱥ���Һ��������Ũ��c��H+������A��ȷ��
B�������¶Ⱥ������ӡ�����������Ũ�ȶ��������Ũ�ȼ�С����$\frac{c��{H}^{+}��}{c��C{H}_{3}COOH��}$�ı�ֵ����B��ȷ��
C��c��H+��•c��OH-��Ϊˮ�����ӻ��������¶Ⱥ�ˮ�ĵ���̶�������ˮ�����ӻ�����C��ȷ��
D�������¶Ⱥ����������ӡ�������Ũ�ȶ���������������Ũ������ķ��ȴ������������ӣ�����$\frac{c��O{H}^{-}��}{c��{H}^{+}��}$�ı�ֵ��С����D����
E.$\frac{c��C{H}_{3}CO{O}^{-}��c��{H}^{+}��}{c��C{H}_{3}COOH��}$Ϊ����ĵ���ƽ�ⳣ���������¶Ⱥ�����ĵ���ƽ�ⳣ������E��ȷ����ѡABCE��
�ʴ�Ϊ��A��ABCE��
��4������ͼ�����֪������ʼ��������Һ��c��H+����ͬ��c�������ᣩ��c����ǿ�ᣩ��ϡ�����н�����ĵ���̶�����������ϡ�����н������c��H+��һֱ���ڽ�ǿ���c��H+����ϡ����ͬ������HX��pH�仯��CH3COOH�Ĵ�HX����ǿ������ƽ�ⳣ����HX����ǿ��CH3COOH�ģ�ϡ�ͺ�HX��Һ��c��H+��С��CH3COOH��Һ�е�c��H+�������Զ�ˮ����������������
�ʴ�Ϊ�����ڣ�ϡ����ͬ������HX��pH�仯��CH3COOH�Ĵ�����ǿ������ƽ�ⳣ�����ڣ�HX����ǿ��CH3COOH�ģ�ϡ�ͺ�HX��Һ�е�c��H+��С��CH3COOH��Һ�е�c��H+�����������ˮ�������������Ҳ������
���� ���⿼����������ʵĵ��뼰��Ӱ�죬��Ŀ�Ѷ��еȣ�����֪ʶ��϶ࡢ�ۺ��Խ�ǿ����ֿ�����ѧ���ķ������������������Ӧ����ѧ֪ʶ����������ȷ�¶ȡ�Ũ�ȵȶԵ���ƽ�ⳣ����ˮ�����ӻ���Ӱ��Ϊ���ؼ���


 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��������֬ˮ���Ʊ����� | |
| B�� | ʳ���ͷ������Ȼ���������廯������к����� | |
| C�� | ������ɱ�����в�������Ϊ���������ȱ��� | |
| D�� | �ǡ���֬�������ʶ���ˮ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��322 g Na2SO4•10H2O����1 Lˮ�У�������Һ�����ʵ���Ũ��Ϊ1 mol/L | |
| B�� | ����2 mol H2SO4����Һ��ˮϡ�͵�2 L��������Һ��H2SO4�����ʵ���Ũ��Ϊ1 mol/L | |
| C�� | ��1 L 18.4 mol/L��H2SO4��Һ����1 Lˮ�У�������Һ�����ʵ���Ũ��Ϊ9.2 mol/L | |
| D�� | ��336 mL HCl��������300 mLˮ��������Һ�����ʵ���Ũ��Ϊ0.05 mol/L |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ��
һ���¶��£���2L���ܱ������У�X��Y��Z������������ʵ�����ʱ��仯��������ͼ��ʾ���鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | HCl��NaCl����ˮ���ƻ��Ļ�ѧ��������ͬ | |
| B�� | ij�����к������Ӽ�������������κ������¾��ɵ��� | |
| C�� | �ɱ��Ƿ��Ӿ��壬������������ֻ��˷����Ӽ������� | |
| D�� | ���³�ѹ�£���̬���ʷ����У�ÿ��ԭ�ӵ�����㶼����8�����ȶ��ṹ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��ͭ����ϡ�����У�Cu+4H++2NO3-=Cu2++2NO2��+H2O | |
| B�� | ��Fe2��SO4��3��Һ�м���������ۣ�Fe3++Fe=2Fe2+ | |
| C�� | ��Al2��SO4��3��Һ�м��������ˮ��Al3++3NH3•H2O=Al��OH��3��+3NH4+ | |
| D�� | Ca��HCO3��2��Һ�м�����NaOH��Һ��HCO3-+Ca2++OH-=CaCO3��+H2O |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com