
分析 混合溶液中n(H2SO4)=4mol/L×0.2L=0.8mol,n(HNO3)=2mol/L×0.2L=0.4mol,混合溶液中n(H+)=2n(H2SO4)+n(HNO3)=0.8mol×2+0.4mol=2mol,发生的离子反应方程式为Fe+2 H+=Fe2++H2↑、3Fe+8H++2 NO3-=3Fe2++2NO↑+4H2O,
根据方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O知,0.4molNO3-完全反应消耗n(H+)=$\frac{0.4mol}{2}×8$=1.6mol,还剩余的氢离子和铁反应生成生成氢气,根据转移电子守恒计算消耗Fe的质量.
解答 解:混合溶液中n(H2SO4)=4mol/L×0.2L=0.8mol,n(HNO3)=2mol/L×0.2L=0.4mol,混合溶液中n(H+)=2n(H2SO4)+n(HNO3)=0.8mol×2+0.4mol=2mol,发生的离子反应方程式为Fe+2 H+=Fe2++H2↑、3Fe+8H++2 NO3-=3Fe2++2NO↑+4H2O,
根据方程式3Fe+8H++2NO3-=3Fe2++2NO↑+4H2O知,0.4molNO3-完全反应消耗n(H+)=$\frac{0.4mol}{2}×8$=1.6mol,还剩余的氢离子和铁反应生成生成氢气,根据转移电子守恒得消耗m(Fe)=$\frac{0.4mol×(5-2)+(2-1.6)mol×1}{(2-0)}$×56g/mol=44.8g,
故答案为:44.8g.
点评 本题以混合物的反应为载体考查氧化还原反应,侧重考查学生分析计算能力,注意:氢离子部分参加氧化还原反应、部分参加非氧化还原反应,结合转移电子守恒解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
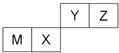
| A. | 原子半径Z<M | |
| B. | Z位于元素周期表中第2周期、第ⅥA族 | |
| C. | X的最简单气态氢化物的热稳定性比Z的小 | |
| D. | X的最高价氧化物不溶于任何酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下:
实验室用MnO2、KOH及KClO3为原料制取高锰酸钾的实验流程如下: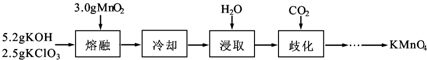
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 |
| ①将镁条用砂纸打磨后,放入试管中,加入少量水后,加热至水沸腾;再向溶液中滴加酚酞溶液 | A.浮在水面上,熔成小球,四处游动,发出“嘶嘶”声,随之消失,溶液变成红色. |
| ②向新制得的Na2S溶液中滴加新制的氯水 | B.有气体产生,溶液变成浅红色 |
| ③将一小块金属钠放入滴有酚酞溶液的冷水中 | C.剧烈反应,迅速产生大量无色气体 |
| ④将镁条投入稀盐酸中 | D.反应不十分剧烈;产生无色气体. |
| ⑤将铝条投入稀盐酸中 | E.生成白色胶状沉淀,继而沉淀消失 |
| ⑥向A1Cl3溶液中滴加NaOH溶液至过量 | F.生成淡黄色沉淀. |
| 实验步骤 | ① | ② | ③ | ④ | ⑤ | ⑥ |
| 实验现象(填A~F) | C | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤 | 实验现象 | 结论及有关化学方程式 |
| A.分别称取相同质量的样品,在空气中燃烧; B.分别称量硫化铜和硫化亚铜灼烧后剩余物质的质量 | A.有一种固体无变化,两种固体产生刺激性气味气体 B.有一种样品质量减轻,一种样品质量不变 | A.固体无变化的是氧化铜,产生刺激性气味气体的是硫化铜和硫化亚铜,在空气中煅烧中反应的化学方程式分别为2CuS+3O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+2SO2; Cu2S+2O2 $\frac{\underline{\;\;△\;\;}}{\;}$2CuO+SO2 B.质量减轻的是硫化铜,质量不变的是硫化亚铜 |
| 实验装置 | 现象 |
 | 1.A试管中黑色沉淀逐渐溶解 2.A试管内上方出现红棕色气体 3.B试管中出现白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验操作 | 预期现象及实验结论 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com