
| A. | $\frac{n}{2.4R}$ mol•L-1 | B. | $\frac{1000nρ}{17n+22.4m}$mol•L-1 | ||
| C. | $\frac{n}{22.4}$mol•L-1 | D. | $\frac{1000ρ}{17n+22.4m}$mol•L-1 |
分析 根据n=$\frac{V}{{V}_{m}}$、m=nM计算出氨气的质量,m mL水的质量约为mg,从而可知所得溶液质量,然后根据V=$\frac{m}{ρ}$计算出氨水体积,最后根据c=$\frac{n}{V}$计算出该氨水的物质的量浓度.
解答 解:标准状况下nL氨气的物质的量为:$\frac{nL}{22.4L/mol}$=$\frac{n}{22.4}$mol,该氨气的质量为:17g/mol×$\frac{n}{22.4}$mol=$\frac{17n}{22.4}$g,
m mL水的质量约为mg,则所得溶液质量为:mg+$\frac{17n}{22.4}$g,所得溶液的体积为:$\frac{\frac{17n}{22.4}g+mg}{1000ρg/L}$=$\frac{17n+22.4m}{22400ρ}$L,
所以该氨水的物质的量浓度为:$\frac{\frac{n}{22.4}mol}{\frac{17n+22.4m}{22400ρ}}$=$\frac{1000ρn}{17n+22.4m}$mol/L,
故选B.
点评 本题考查了物质的量浓度的计算,题目难度中等,正确计算氨水的体积为解答关键,注意熟练掌握物质的量浓度的概念及表达式,试题培养了学生的分析能力及化学计算能力.


 提分百分百检测卷系列答案
提分百分百检测卷系列答案科目:高中化学 来源: 题型:选择题
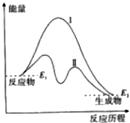
| A. | 曲线Ⅰ和曲线Ⅱ分别表示两个化学反应的能量变化 | |
| B. | 曲线Ⅱ可表示反应2NH3$?_{高温高压}^{催化剂}$N2+3H2的能量变化 | |
| C. | 该反应不需要加热就能发生 | |
| D. | 该反应的△H=E2-E1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
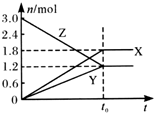 在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )
在一定温度下,将一定量的气体通入体积为2 L的密闭容器中,使其发生反应,有关物质X、Y、Z的物质的量的变化如图所示.则下列有关推断正确的是( )| A. | 该反应的化学方程式为:3Z═3X+2Y | B. | t0时,X、Y、Z的质量不再改变 | ||
| C. | t0时,Z的浓度为1.2 mol/L | D. | t0时,反应停止,反应速率为0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
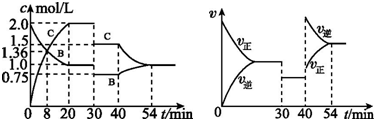
| A. | 30 min~40 min 间该反应使用了催化剂 | |
| B. | 反应方程式中的x=2,正反应为吸热反应 | |
| C. | 30 min 时条件的变化是降低压强,40 min 时条件的变化是升高温度 | |
| D. | 前8 min A 的平均反应速率为0.08 mol•L-1•min-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3(m-n) mL | B. | $(m+\frac{n}{3})$ mL | C. | $\frac{n-m}{3}$ mL | D. | $\frac{4n-m}{12}$ mL |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
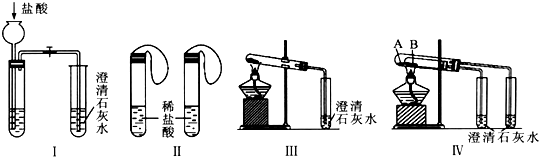
| 实验方案 | 预测现象 | 预测依据 |
| 操作1:向2 mL Na2CO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 有白色沉淀 | Na2CO3溶液中的CO32-浓度较大,能与CaCl2发生反应Ca2++CO32-=CaCO3↓(写离子方程式) |
| 操作2:向2 mL NaHCO3溶液中滴加1 mL 0.5 mol•L-1 CaCl2溶液 | 无白色沉淀 | NaHCO3溶液中的CO32-浓度很小,不能与CaCl2反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 稀硝酸和碳酸钠 | B. | 氧化铜和稀硝酸 | C. | 碳和浓硫酸 | D. | 铜和浓硝酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 苯氧乙酸甲酯的分子式为C9H10O3 | |
| B. | 苯氧乙酸与邻羟基苯乙酸不互为同分异构体 | |
| C. | 苯酚和邻羟基苯乙酸可用FeCl3溶液检验 | |
| D. | ClCH2COOH与足量烧碱溶液共热所得有机物为HOCH2COOH |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
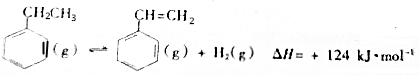
| 化学键 | C-H | C-C | C=C | H-H |
| 键能/kJ•molˉ1 | 412 | 348 | x | 436 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com