
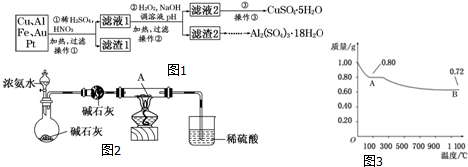
 利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.
利用废铝箔(主要成分为Al、少量的Fe、Si等)既可制取有机合成催化剂AlBr3又可制取净水剂硫酸铝晶体.分析 I.(1)铝箔表面会有油污,根据相似相溶原理知,有机溶质易溶于有机溶剂;
(2)溴化铝易水解生成氢氧化铝和HBr;
(3)如果溴过量,溴易混入溴化铝中;
(4)当5的管中回流液呈无色或烧瓶6中物质呈无色,说明可以停止回流;
(5)将溴化铝蒸汽导入装置2中并冷凝得到溴化铝;
II.(6)③根据图片知,pH在4-10时生成氢氧化铝沉淀;
⑥从溶液中获得晶体采用加热浓缩、冷却结晶的方法.
解答 解:I.(1)铝箔表面易沾有油脂,油脂属于有机物,根据相似相溶原理知,有机溶质易溶于有机溶剂,所以用四氯化碳除去铝箔表面的油脂,
故答案为:除去铝箔表面的油脂等有机物;
(2)溴化铝易水解生成氢氧化铝和HBr,为防止溴化物在空气中的水蒸气中水解,用氮气将装置中空气(含水蒸气)排出,
故答案为:排出装置中含有水蒸气的空气;
(3)如果溴过量,溴易混入溴化铝中,所以为保证液溴完全反应,该实验要保证烧瓶中铝箔过剩,
故答案为:保证溴完全反应,防止溴过量混入溴化铝中;
(4)当5的管中回流液呈无色或烧瓶6中物质呈无色,说明溴恰好完全反应,则可以停止回流,
故答案为:5的管中回流液呈无色(或烧瓶6中物质呈无色);
(5)步骤5需打开导管口l和4,利用压强差将溴化铝蒸汽导入装置2并冷凝得到溴化铝,
故答案为:将AlBr3蒸气导入装置2中并冷凝;
II.(6)③根据图片知,pH在4-10时生成氢氧化铝沉淀,所以该步骤是向溶液中滴加稀硫酸并调节溶液pH为4-10,从而得到氢氧化铝沉淀,
故答案为:滤液用2.0mol/L硫酸在不断搅拌下调到pH4-10左右;
⑥从溶液中获得晶体采用加热浓缩、冷却结晶的方法,所以该操作为蒸发浓缩,故答案为:蒸发浓缩.
点评 本题考查AlBr3、硫酸铝制备实验方案设计,侧重考查学生制备、操作等基本能力,明确实验原理是解本题关键,题目难度中等.


 阳光试卷单元测试卷系列答案
阳光试卷单元测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 | |
| B. | 用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 | |
| C. | 用惰性电极电解饱和KBr溶液,若有1 mol电子转移,则生成1 molKOH | |
| D. | 镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验序号 | HCl溶液浓度(mol/L) | BOH溶液溶液(mol/L) | 混合后溶液pH |
| 甲 | 0.10 | 0.10 | 4.7 |
| 乙 | 0.10 | 0.30 | 7 |
| 丙 | 0.10 | 0.50 | 8.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:
在2L密闭容器中,800℃时反应2NO(g)+O2(g)?2NO2(g)体系中,n(NO)随时间的变化如表:| 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

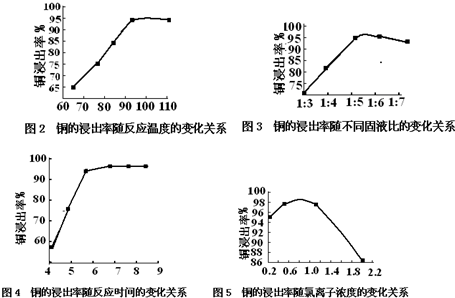
| 反应温度/℃ | 固液比 | c(Cl-)/mol•L-1 | 反应时间/h | |
| A | 95 | 1:5.5 | 0.8 | 6 |
| B | 100 | 1:5.5 | 0.7 | 7 |
| C | 110 | 1:6 | 0.9 | 8 |
| 滴定次数 | 待测溶液的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00mL | 0.02 | 40.01 |
| 2 | 25.00mL | 0.70 | 40.71 |
| 3 | 25.00mL | 0.20 | 39.20 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应.
A、B、C、D、E、F是中学中常见的物质,其转化关系如图所示(反应条件未标出),已知反应①是置换反应. ,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
,反应③的化学方程式为4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com