
分析 (1)已知:①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变;
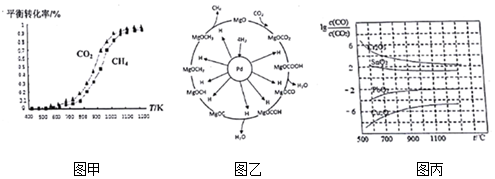
(2)①根据图示可以看出,CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0;
(3)根据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”结合反应机理来书写方程式并结合化合价判断;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变;
B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合;
C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高;
D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0;
(5)依据电解原理阴极上是得到电子发生还原反应生成一氧化碳.
解答 解:(1)①CH4(g)═C(s)+2H2(g)△H=+75.0kJ/mol
②CO2(g)+H2(g)═CO(g)+H2O(g)△H=+41.0kJ/mol
③CO(g)+H2(g)═C(s)+H2O(g)△H=-131.0kJ/mol
反应CO2(g)+CH4(g)═2CO(g)+2H2(g)可以是①+②-③得到,根据盖斯定律计算反应的焓变△H=+247kJ/mol,
故答案为:+247;
(2)①根据图示可以看出,CO2发生了其他副反应,同温度下CO2的平衡转化率大于CH4的平衡转化率大于,
故答案为:大于;CO2发生了其他副反应;
②反应自发进行的判据:△H-T△S<0,反应①△S>0,△H>0,代入判据,得到反应在高温下能自发进行,
故答案为:该反应△H>0,△S>0,高温时△G=△H-T△S<0;
(3)据信息:一定条件下Pd-Mg/SiO2催化剂可使CO2“甲烷化”,可以写出方程式为:CO2+4H2$\frac{\underline{\;Pb-Mg/SIO_{2}\;}}{\;}$CH4+2H2O,
故答案为:CO2+4H2=$\frac{\underline{\;Pb-Mg/SIO_{2}\;}}{\;}$CH4+2H2O;
(4)A、增高炉的高度,增大CO与铁矿石的接触,不能影响平衡移动,CO的利用率不变,故A错误;
B、由图象可知用CO工业冶炼金属铬时,lg[c(CO)/c(CO2)]一直很高,说明CO转化率很低,故不适合,故B正确;
C、由图象可知温度越低lg[c(CO)/c(CO2)]越小,故CO转化率越高,故C正确;
D、由图象可知CO还原PbO2的温度越高lg[c(CO)/c(CO2)]越高,说明CO转化率越低,平衡逆向移动,故△H<0,故D错误;
故答案为:BC;
(5)以Pt为阳极,Pb(CO2的载体)为阴极,KHCO3溶液为电解质溶液,还原消除航天器内CO2同时产生O2和新的能源CO,总反应的化学方程式为:2CO2$\frac{\underline{\;通电\;}}{\;}$2CO+O2,则溶液中的氢氧根在阳极上失去电子发生氧化反应生成氧气,电极反应式为:4OH--4e-=O2↑+2H2O,阴极电极反应为CO2+H2O+2e-═CO+2OH-,
故答案为:CO2+H2O+2e-═CO+2OH-.
点评 本题涉及反应的方向判断、盖斯定律的应用以及沉淀溶解平衡常数的计算知识,属于综合知识的考查,题目难度中等.


科目:高中化学 来源: 题型:实验题
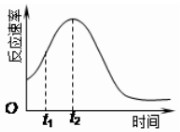 某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.
某化学兴趣小组在一次实验探究中发现,向草酸溶液中逐滴加入酸性高锰酸钾溶液时,发现反应速率变化如图所示,小组成员探究t1~t2时间内速率变快的主要原因,为此“异常”现象展开讨论,猜想造成这种现象的最可能原因有两种.| 试管A | 试管B | |
| 加入试剂 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4 | 2mL0.1mol/L H2C2O4溶液、1mL 0.05mol/L 酸性KMnO4,少量MnSO4(s)固体(填物质名称) |
| 实验现象(褪色时间) | 褪色时间10min | 褪色时间<10min(选填“<”“>”或“=”) |
| 结论 | 猜想Ⅱ正确 | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
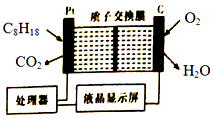 某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )
某油库为了强化安全管理,引进一台空气中汽油含量的测量仪,其工作原理如图所示(用强酸性溶液作电解质溶液).下列说法不正确的是( )| A. | 石墨电极作正极,发生还原反应 | |
| B. | H+由质子交换膜右侧向左侧迁移 | |
| C. | 每消耗标况下5.6LO2,电路中通过1 mol电子 | |
| D. | 铂电极的电极反应式:C8H18+16H20-5Oe-═8CO2↑+50H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 3种 | B. | 18种 | C. | 9种 | D. | 12种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该元素一定被氧化 | B. | 该元素一定被还原 | ||
| C. | 该元素可能被氧化也可能被还原 | D. | 生成的单质为还原产物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
,用化学方程式表示出它作供氧剂的原理:2CaO2+2H2O=2Ca(OH)2+O2↑.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com