
| m |
| M |
| m |
| ρ |
| n |
| V |
| 11.5g |
| 23g/mol |
| 0.5mol×2 |
| 2 |
| 0.5mol×1 |
| 2 |
| 100g |
| 1.25g/mL |
| 0.5mol |
| 0.08L |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
 胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( )
胡椒酚是植物挥发油中的一种成分.关于胡椒酚的下列说法,其中正确的是( )| A、①③ | B、①②④ |
| C、②③ | D、②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、试剂X可能是葡萄糖 |
| B、试剂Z一定是CO2 |
| C、工业上可用CO还原固体2制取金属2 |
| D、工业上用固体3经一步反应制取金属3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、吸滤瓶内液面高度将达到支管口时,应拔掉吸滤瓶上的橡皮管,并从吸滤瓶支管口倒出溶液 |
| B、在两支试管中分别加1ml无水乙醇和1.5g苯酚固体,再加等量等体积的钠,比较乙醇、苯酚羟基上氢原子的活泼性 |
| C、在“牙膏中某些主要成分的检验”实验中,在牙膏与蒸馏水搅拌、静置分离后的澄清溶液中加入少量的新制Cu(OH)2,当产生绛蓝色沉淀时,说明牙膏中含有甘油 |
| D、在盛有氯化钴溶液的试管中,加入一定量的浓盐酸,溶液的颜色由粉红色变为蓝色 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、新能源汽车的推广与使用有助于减少光化学烟雾的产生 |
| B、酸雨形成的主要原因是汽车尾气的任意排放 |
| C、推广煤的气化、液化技术,提供清洁高效燃料 |
| D、用K2FeO4取代Cl2处理饮用水,有杀菌消毒作用,且不会形成致癌物,但无净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:
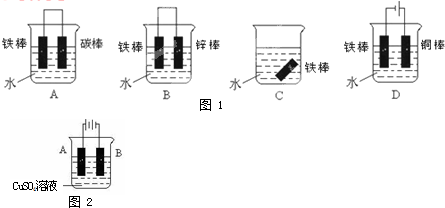
查看答案和解析>>
科目:高中化学 来源: 题型:
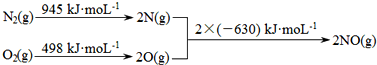
查看答案和解析>>
科目:高中化学 来源: 题型:
 某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:
某研究性学习小组用电解CuSO4溶液的方法测定铜的相对原子质量(装置如图),实验中测得某电极的质量增重为m g,已知氧元素相对原子质量为16.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:

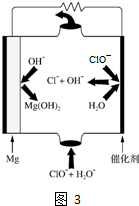
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com