
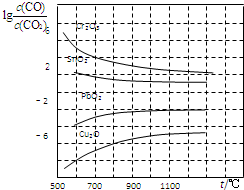
 一氧化碳是一种用途相当广泛的化工基础原料.
一氧化碳是一种用途相当广泛的化工基础原料.| 50-80℃ |
| 180-200℃ |
| 物质 | H2 | CO | CH3OH |
| 浓度/(mol?L-1) | 0.2 | 0.1 | 0.4 |
| c(CO) |
| c(CO2) |
| n(CO)(反应) |
| n(CO)(反应开始) |
| △c |
| △t |
| ||
| c 3(CO2) |
| c 3(CO) |
 Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;
Ni(CO)4(g)为化合反应,大多数的化合反应为放热反应,放热反应的△H<0,故答案为:<;| n(CO)(反应) |
| n(CO)(反应开始) |
| (1-0.4)mol |
| 2mol |
| 0.4 |
| 0.22×0.1 |
| 0.3mol/L |
| 10min |
| ||
| c 3(CO2) |
| c 3(CO) |
| 1 |
| K |
| c 3(CO2) |
| c 3(CO) |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
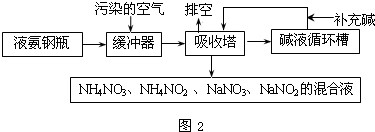
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、塑料、橡胶、纤维都是有机高分子化合物 |
| B、核电站泄露的放射性物质131I和127I互为同位素,化学性质相似 |
| C、以NO和NO2为主的氮氧化物是形成光化学烟雾和酸雨的一个重要原因 |
| D、氢氧化铁胶体、含PM2.5(是指大气中直径接近于2.5×10-5m的细颗粒物)的大气均具有丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
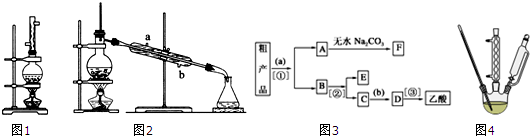
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
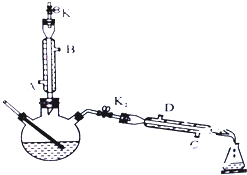 如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题
如图所示为制取乙酸乙酯的实验装置改进图,请回答下列问题查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
2- 3 |
2- 4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
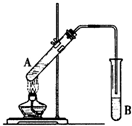 在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.
在试管A中加入3mL乙醇,然后边振荡管边慢慢加入2mL浓硫酸和2mL乙酸,按如图所示连接好装置进行实验,以制取乙酸乙酯.查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com