
【题目】下列四个试管中,均发生反应Zn+2HCl=ZnCl2+H2↑,产生H2的反应速率最小的是
试管 | 盐酸浓度(mol/L) | 温度(℃) | 锌的状态 |
A | 0.5 | 20 | 块状 |
B | 0.5 | 20 | 粉末状 |
C | 2 | 35 | 块状 |
D | 2 | 35 | 粉末状 |
A. AB. BC. CD. D
科目:高中化学 来源: 题型:
【题目】有A、B、C、D、E五种元素,其相关信息如表:
元素 | 相关信息 |
A | A原子的1s轨道上只有1个电子 |
B | B是电负性最大的元素 |
C | C基态原子的2p轨道中有3个未成对电子 |
D | D是主族元素且与E同周期,其最外能层上有2个运动状态不同的电子 |
E | E能形成红色(或砖红色)的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)写出E元素原子基态时的电子排布式_______________。
(2)C元素的第一电离能比氧元素的第一电离能_______________ (填“大”或“小”) 。
(3)CA3分子中C原子的杂化类型是_______________。
(4)A、C、E三种元素可形成[E(CA3)4]2+,其中存在的化学键类型有____(填序号);
①配位键 ②金属键 ③极性共价键 ④非极性共价键 ⑤离子键 ⑥氢键
若[E(CA3)4]2+具有对称的空间构型,且当[E(CA3)4]2+中的两个CA3被两个Cl取代时,能得到两种不同结构的产物,则[E(CA3)4]2+的空间构型为____________ (填序号)。
a.平面正方形 b.正四面体 c.三角锥形 d.V形
(5)B与D可形成离子化合物,其晶胞结构如图所示,其中D离子的配位数为_______________,若该晶体的密度为a g·cm3,则该晶胞的体积是_____________cm3(写出表达式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着工业的发展,酸雨已经称为全球性的环境问题。
(1)当雨水的pH___________,我们称它为酸雨。
(2)用化学方程式来表示酸雨形成的主要途径之一:_____________________,_______________。
(3)常温下测得某次酸雨样品的pH=5,则该样品中c(H+)=_____________,该样品放置一段时间后,酸性略有增强,其原因可能是________________________________________________。
(4)写出一条减少二氧化硫排放的措施_________________________________________。
(5)检验某无色溶液中是否存在SO42-的方法是_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100 mL 0.3 mol·L-1 Na2SO4溶液和50 mL 0.2 mol·L-1 Al2(SO4)3溶液混合后,溶液中SO42-的物质的量浓度为( )
A. 0.20 mol·L-1B. 0.25 mol·L-1
C. 0.40 mol·L-1D. 0.50 mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种元素A、B、C、D,其中B2-与C+核外电子排布与Ne相同,B原子与C原子的质子数之和等于D原子的质子数,A原子失去一个电子后变成一个质子,试回答:
(1)A、B、C、D的元素符号分别为________、_______、________、________。
(2)B2-的电子式为______,C+离子的电子式为______,D原子的结构示意图为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列四个图像:

下列反应中全部符合上述图像的反应是 ( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH1<0
2NH3(g) ΔH1<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH2>0
2SO2(g)+O2(g) ΔH2>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH3<0
4NO(g)+6H2O(g) ΔH3<0
D. H2(g)+ CO(g)![]() C(s)+H2O(g) ΔH4>0
C(s)+H2O(g) ΔH4>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯及其化合物用途广泛,其中NaCl和HCl是两种重要的含氯化合物。
(1)NaCl的电子式为___,HCl的电子式___。
(2)工业上生产氯气的方法是电解饱和食盐水,写出该反应的化学方程式:___,电解时氯气在___极得到,可用___来检验其存在。
(3)实验室制备氯化氢气体的化学方程式为___。
(4)如图为H2和Cl2燃烧的反应能量变化示意图,请根据此图写出该反应的热化学方程式:___。
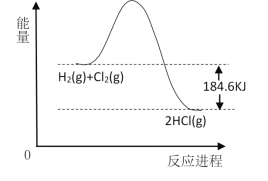
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海带具有从海水中富集碘的能力,从海带中提取单质碘的流程图如图:

(1)在上述操作中,哪一过程是萃取(_____)。
A.b B.c C.d D.e
(2)写出步骤d的离子方程式:____。
(3)四氯化碳能从碘水中萃取出碘的原因是(1)__(2)__,在进行萃取分液操作时,需要用到的玻璃仪器有____、___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一体积为1L的密闭容器中,通入一定量的CO和H2O,在T1℃时发生如下反应:CO (g)+H2O(g) ![]() CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
CO2(g)+H2(g) △H<0,CO和H2O浓度变化如图,则
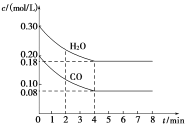
(1) 0~4 min CO的平均反应速率v(CO)=___________mol/(L.min)。
(2)达平衡时CO的转化率为____________,T1℃时该反应的平衡常数K=_______________。
(3)T2℃(高于T1℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如下表:
时间(min) | CO | H2O | CO2 | H2 |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | C1 | C2 | C3 | C3 |
4 | C1 | C2 | C3 | C3 |
5 | 0.116 | 0.216 | 0.084 | C4 |
①表中3~4 min时,反应v正__________v逆(填“>”、“<”或“=”); C1___________0.08mol/L(填“>”、“<”或“=”)。
②4~5 min时,平衡向逆反应方向移动,可能的原因是__________(填字母)。
a.增加水蒸气 b.降低温度 .增大了CO2浓度 d.增加了氢气浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com