
【题目】今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置如图所示,且它们的质子数之和为32。D元素原子的最外层电子数为次外层电子数的2倍。下列说法正确的是

A.原子半径:D>A>CB.常温常压下,B单质为固态
C.气态氢化物热稳定性:B>CD.C的最高价氧化物的水化物是强酸
【答案】AB
【解析】
A、B、C、D为短周期主族元素,其中A、B、C在周期表中所处的位置且它们的质子数之和为32,设B上面的元素质子数为x,则A质子数为x-1,C质子数为x+1,B的质子数为x+8,因此有x-1 + x+1 +x +8 =32,x = 8,则A为N,B为S,C为F,D元素原子的最外层电子数为次外层电子数的2倍,则D为C。
A选项,从左到右原子半径逐渐减小,从上到下,原子半径逐渐增大,所以原子半径:C>N> F,故A正确;
B选项,常温常压下,B为单质硫,是固态,故B正确;
C选项,元素的非金属性越强,气态氢化物稳定性越强,因此气态氢化物热稳定性:HF > H2S,故C错误;
D选项,C元素为F,F元素没有最高价氧化物的水化物,故D错误;
综上所述,答案为AB。


科目:高中化学 来源: 题型:
【题目】下列实验装置图,其中关于用途的描述,不正确的是( )
A. 装置:收集二氧化碳,从a口进气b口排气
装置:收集二氧化碳,从a口进气b口排气
B. 装置:用于石油的分馏
装置:用于石油的分馏
C. 装置:用于分离Cl2与KI溶液反应生成的碘
装置:用于分离Cl2与KI溶液反应生成的碘
D. 装置:可用来制取氨气
装置:可用来制取氨气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图中所示反应是__(填“吸热”或“放热”)反应,该反应的ΔH=__(用含E1、E2的代数式表示)。

(2)已知热化学方程式:H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为___。
O2(g)=H2O(g) ΔH=-241.8kJ/mol,该反应的活化能为167.2kJ/mol,则其逆反应的活化能为___。
(3)依据事实,写出下列反应的热化学方程式:
①2molH2与2molI2蒸汽完全反应时,生成碘化氢气体,放出了29.8KJ的热量___。
②1克甲烷完全燃烧生成二氧化碳和液态水放出了akJ的热,写出甲烷燃烧热的热化学方程式:__。
(4)中和热的测定实验的关键是要比较准确地配制一定的物质的量浓度的溶液,在实验过程中要尽量避免热量的散失,要求比较准确地测量出反应前后溶液温度的变化。回答下列问题:
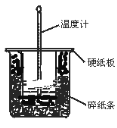
①从实验装置图看,图中尚缺少的一种玻璃用品是___。
②在大小烧杯之间填满碎泡沫(或纸条)其作用是__;
③该实验常用0.50mol·L-1HCl和0.55mol·L-1的NaOH溶液各50mL。解释NaOH的浓度稍大的原因__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,可逆反应C(s)+CO2(g)![]() 2CO(g),达到平衡状态的标志是( )
2CO(g),达到平衡状态的标志是( )
①单位时间内生成n molCO2的同时生成n molC ②单位时间内生成n molCO2 的同时生成2n mol CO ③CO2 、CO的物质的量浓度之比为1: 2的状态 ④混合气体的密度不再改变的状态 ⑤混合气体的压强不再改变的状态 ⑥C的质量不再改变的状态
A. ①④⑤⑥ B. ②④⑤⑥ C. ②③⑤⑥ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】相同温度下,在体积相等的三个恒容密闭容器中发生可逆反应:2SO3(g)![]() 2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
2SO2(g)+O2(g)△H=+197kJ/mol。实验测得起始、平衡时的有关数据如下表:
容器编号 | 起始时各物质物 质 的量 /mol | 平衡时反应中的能量变化 | ||
SO3 | SO2 | O2 | ||
① | 2 | 0 | 0 | 吸收热量akJ |
② | 0 | 2 | 1 | 放出热 量 bkJ |
③ | 4 | 0 | 0 | 吸收热量ckJ |
下列叙述正确的是( )
A. 达平衡时O2的体积分数:①>③
B. 热量关系:a一定等于b
C. ①②③ 反应的平衡常数:③>①>②
D. ①中的密度不再改变时说明反应已达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请按下列要求填空:
(1)已知,NaBH4与水反应:BH4- +2H2O=BO2-+4H2↑(反应实质为水电离出来的H+被还原),反应后所得溶液显碱性,用离子方程式表示出溶液显碱性的原因___________________________________。
(2)广义的水解观认为:水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化.根据以上信息,下列物质水解后的产物错误的是 ___________
①BaO2的水解产物是Ba(OH)2和H2O2 ②PCl3水解的产物是HClO和PH3
③CaC2水解的产物是Ca(OH)2和C2H2 ④Al2S3水解的产物是Al(OH)3和H2S
⑤TiCl4水解产物是TiO2·xH2O和HCl
(3)化学反应可为人类提供能量。已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1 = -a kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2 = -b kJ/mol
③ H2O(g)= H2O(l) ΔH3 = -c kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:_____________________
(4)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
溶质 | CH3COONa | NaHCO3 | Na2CO3 | NaClO | NaCN |
pH | 8.8 | 9.7 | 11.6 | 10.3 | 11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是_______。
A.HCN B.HClO C.CH3COOH D.H2CO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是![]()
A.比例模型![]() :可以表示二氧化碳分子,也可以表示水分子
:可以表示二氧化碳分子,也可以表示水分子
B.室温下,将![]() HA溶液和
HA溶液和![]() 溶液等体积混合
溶液等体积混合![]() 忽略混合时溶液体积的变化
忽略混合时溶液体积的变化![]() 测得混合溶液的
测得混合溶液的![]() ,则混合溶液中由水电离出的
,则混合溶液中由水电离出的![]()
C.纯碳新材料“碳纳米泡沫”,每个泡沫含有约4000个碳原子,直径约6到9nm,在低于![]() 时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素
时,泡沫具有永久磁性,“碳纳米泡沫”与石墨互为同位素
D.已知![]() 的
的![]() 为
为![]() ,则将等体积的
,则将等体积的![]()
![]() 的
的![]() 溶液和
溶液和![]()
![]() 溶液混合,不会有
溶液混合,不会有![]() 沉淀产生
沉淀产生
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L的密闭容器中,加入2 mol X(g)和1 mol Y(g)发生反应:2X(g)+mY(g)![]() 3Z(g),平衡时,X、Y、Z的体积分数分别为60%、30%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
3Z(g),平衡时,X、Y、Z的体积分数分别为60%、30%、10%。在此平衡体系中加入1 mol Z(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是( )
A.m=1B.第二次平衡时,Y的浓度为1.2 mol·L-1
C.两次平衡的平衡常数相同D.X与Y的平衡转化率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学兴趣小组欲测量碳铁合金的含碳量,提出了如下三种实验方案。
方案Ⅰ:含碳铁合金粉末与浓硫酸在一定条件下反应,用下列装置![]() 加持装置省略
加持装置省略![]() 既可检验产物中除
既可检验产物中除![]() 外混合气体的成分,又可通过测量
外混合气体的成分,又可通过测量![]() 的质量来计算合金的含碳量。
的质量来计算合金的含碳量。
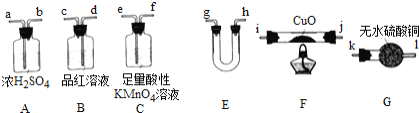
(1)合金与浓硫酸在一定条件下生成![]() 的反应中,做还原剂的物质时____(填化学式)。
的反应中,做还原剂的物质时____(填化学式)。
(2)为实现实验目的,上述仪器正确的连接顺序![]() 按气流方向
按气流方向![]() 为:混合气体→____→____→______→(a)(b)→_____→_______→(k)(l)。
为:混合气体→____→____→______→(a)(b)→_____→_______→(k)(l)。
(3)装置E中所装药品为 ______ ![]() 填字母序号
填字母序号![]() ;在本实验中的作用是 ______ 。
;在本实验中的作用是 ______ 。
A 碱石灰 B 无水氯化钙 C 浓硫酸
(4)若能观察到 ______ 的现象,则证明原混合气体中一定含有![]() 。
。
(5)实验后最终测量的含碳量偏低,某同学猜测混合气体中有可能含有CO,在G后增加一个装置即可验证他的猜测,请简要说明验证这个猜测所需装置及药品和具体实验现象 ______ 。
方案Ⅱ:称取粉末状样品![]() ,加入某浓度的稀硫酸100mL,充分反应后,收集到标准状况下气体
,加入某浓度的稀硫酸100mL,充分反应后,收集到标准状况下气体![]() ,然后继续往样品中加入同浓度的稀硫酸100mL,充分反应后又收集到标准状况下气体1.12L。则合金中碳的质量分数为 ______(保留三位有效数字)。
,然后继续往样品中加入同浓度的稀硫酸100mL,充分反应后又收集到标准状况下气体1.12L。则合金中碳的质量分数为 ______(保留三位有效数字)。
方案Ⅲ:利用灼烧法使合金中的碳转化为二氧化碳,合金质量会减轻从而计算含碳量,但是他们将一定量的样品灼烧后,发现质量反而增加了,其原因是 ______ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com