
| A. |  配制一定浓度的稀硫酸 | B. |  实验室制取氨气 | ||
| C. |  蒸发饱和食盐水 | D. | 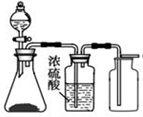 制取、收集氢气 |
分析 A.不能在容量瓶中稀释浓硫酸;
B.氧化钙和水反应生成氢氧化钙,放出大量的热,有利于氨气的挥发;
C.蒸发食盐水,应在蒸发皿中进行;
D.氢气密度比空气小,用向下排空法收集.
解答 解:A.容量瓶只能用于配制一定浓度的溶液,不能在容量瓶中稀释浓硫酸,故A错误;
B.氧化钙和水反应生成氢氧化钙,放出大量的热,有利于氨气的挥发,可用于制备氨气,故B正确;
C.蒸发食盐水,应在蒸发皿中进行,不能用坩埚,故C错误;
D.氢气密度比空气小,用向下排空法收集,故D错误.
故选B.
点评 本题考查较为综合,涉及物质的制备、分离以及溶液的配制等操作,侧重于学生评价能力和实验能力的考查,为高考常见题型,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 根据图1可知合成甲醇的热化学方程式为CO(g)+2H2(g)═CH3OH(g)△H1=(b-a)kJ•mol-1 | |
| B. | 图2表示2 mol H2(g)所具有的能量比2 mol气态水所具有的能量多483.6 kJ | |
| C. | 1 mol NaOH分别和1 mol 稀硫酸、1 mol浓硫酸反应,前者的△H比后者的△H大 | |
| D. | 汽油燃烧时将全部的化学能转化为热能 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:
,Y、Z为同周期金属元素,Y、Z的最高价氧化物对应水化物可以反应生成盐和水.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| Mn(OH)2 | Fe(OH)2 | Fe(OH)3 | Cu(OH)2 | |
| 开始沉淀时 | 8.3 | 6.3 | 2.7 | 4.7 |
| 完全沉淀时 | 9.8 | 8.3 | 3.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com