
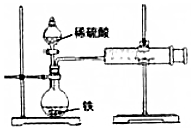
 某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.
某小组的同学们利用如图装置,探究不同条件对铁与酸反应速率的影响.分析 (1)铁和稀硫酸反应生成硫酸亚铁和氢气;
(2)升温加快化学反应速率;
(3)浓度越大化学反应速率越快,但是铁与浓硫酸会发生钝化反应;
(4)构成原电池可加快化学反应速率.
解答 解:(1)铁和稀硫酸反应生成硫酸亚铁和氢气,反应的离子方程式为:Fe+2H+=Fe2++H2↑;
故答案为:Fe+2H+=Fe2++H2↑;
(2)升温加快化学反应速率,故产生气泡的速率将加快;由此得出的结论是升温可使铁与酸的反应速率加快,
故答案为:加快;升温可使铁与酸的反应速率加快;
(3)浓度越大化学反应速率越快,但是铁与浓硫酸会发生钝化反应,故将稀硫酸换为浓硫酸,可观察到铁的表面没有气泡;原因是浓硫酸将铁钝化,
故答案为:铁的表面没有气泡; 浓硫酸将铁钝化;
(4)构成原电池可加快化学反应速率,故同意乙的观点;欲证明此观点,可另取一套上图装置,向烧瓶中直接加入少量铜粉,目的是构成Fe-Cu原电池,
故答案为:乙; 铜粉.
点评 本题考查化学反应速率的影响及探究,侧重实验探究能力和分析能力的考查,注意物质本性为确定反应速率的内因,把握外因对反应速率影响及控制变量法分析实验方案,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 糖类、油脂和蛋白质均是高分子化合物 | |
| B. | 雾能产生丁达尔效应,雾属于胶体 | |
| C. | 新制氯水、HClO和SO2都有漂白作用 | |
| D. | 硝酸能与苯发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
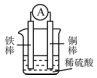
| A. | 铜棒逐渐溶解,溶液由无色慢慢地变为黄色 | |
| B. | 铁棒为负极,电子从铁棒经外电路流向铜棒 | |
| C. | 电池工作一段时间后,溶液的酸性将增强 | |
| D. | 该电池的总反应为Fe2++Cu═Fe+Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量的二氧化碳通入NaOH溶液中:CO2+OH-═HCO3- | |
| B. | 氯气通入水中:Cl2+H2O═Cl-+ClO-+2H+ | |
| C. | 硫酸亚铁溶液加入过氧化氢溶液 Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | 向AlCl3溶液中过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Al2(SO4)3溶液中加入过量氨水:Al3++3NH3•H2O═Al(OH)3↓+3 NH4+ | |
| B. | 向FeI2溶液中加入少量氯水:2 Fe2++Cl2═2Fe3++2Cl-(已知:2Fe3++2I-═2 Fe2++I2) | |
| C. | 将过量铁粉投入稀硝酸中:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| D. | 将SO2通入Na2O2粉末中的主要反应为:2Na2O2+2SO2═2 Na2SO3+O2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
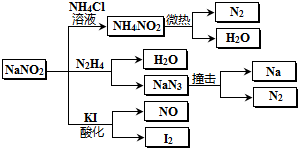
| A. | 分解NaN3盐每产生1molN2 转移6mol e- | |
| B. | NaNO2与N2H4反应中,NaNO2是氧化剂 | |
| C. | 可用KI一淀粉试纸和食醋鉴别NaNO2和NaCl | |
| D. | 实验室可用NaNO2和NH4Cl溶液混合加热制取氮气 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
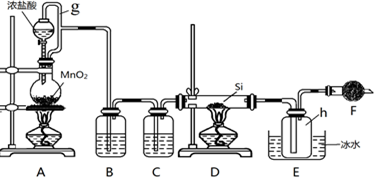
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com