

| ||
| ||


科目:高中化学 来源: 题型:
| ||
| A、水煤气是二级能源 |
| B、水力是二级能源 |
| C、天然气是二级能源 |
| D、电能是一级能源 |
查看答案和解析>>
科目:高中化学 来源: 题型:
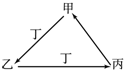 甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )
甲、乙、丙、丁四种物质中,甲、乙、丙均含有相同的某种元素,它们之间具有如下图转化关系.下列有关物质的推断正确的是( )| A、若甲为N2,则丁可能是O2 |
| B、若甲为Fe,则丁可能是Cl2 |
| C、若甲为AlCl3,则丁可能是NH3 |
| D、若甲为NaHCO3,则丁可能是HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:

| Fe3+ | Cu2+ | Cr3+ | |
| 开始沉淀pH | 2.1 | 4.7 | 4.3 |
| 完全沉淀pH | 3.2 | 6.7 | a |
| 3 | 63 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 加热前质量 | 加热后质量 | |
| m1(容器) | m2(容器+晶体) | m3(容器+无水硫酸铜) |
| 5.400g | 7.900g | 7.100g |
查看答案和解析>>
科目:高中化学 来源: 题型:
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| c(CO)?c(H2) |
| c(H2O) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com