
| A. | 乙烯可作为水果的催熟剂 | |
| B. | 用二氧化碳制全降解塑料,可以缓解温室效应 | |
| C. | 氧化铝陶瓷和光导纤维都属于无机非金属材料 | |
| D. | 丙烷(C3H8)和乙醇(C2H5OH)均存在同分异构体 |
分析 A.乙烯是一种植物激素,可用作水果和蔬菜的催熟剂;
B.二氧化碳是产生温室效应的一种气体;
C.新型无机非金属材料主要有先进陶瓷、非晶体材料、人工晶体、无机涂层、无机纤维等;
D.丙烷只有一种结构.
解答 解:A.乙烯是一种植物激素,可用作水果和蔬菜的催熟剂,故A正确;
B.二氧化碳是产生温室效应的一种气体,所以将二氧化碳转化为塑料,能减少温室效应,故B正确;
C.光导纤维、氧化铝陶瓷等属于新型无机非金属材料,故C正确;
D.丙烷只有一种结构,无同分异构体,故D错误.
故选D.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案科目:高中化学 来源: 题型:解答题
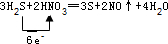 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Na+、OH- | B. | Na+、NO3-、Cl- | ||
| C. | K+、H+、HCO3- | D. | Ca2+、SO42-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制240mL 0.1mol/LCuSO4溶液需称取胆矾6.3g | |
| B. | 金属氧化物一定是碱性氧化物 | |
| C. | 1L水中溶解58.5g NaCl,该溶液中NaCl的物质的量浓度为1 mol•L-1 | |
| D. | 胶体区别于其他分散系的本质特征是能够产生丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 现代化学元素分析测试中,可用元素分析仪确定物质中是否含有C、H、O、N、S、Cl、Br等元素,用红外光谱仪确定物质中是否存在某些有机原子团,用原子吸收光谱确定物质中含有哪些金属元素等 | |
| B. | 钠钾合金在常温下是液体,可用于快中子反应堆作剂;镁合金大量用于制造火箭、导弹和飞机的部件等 | |
| C. | 2015年浙江省多地遭遇雾霾天气,有报道称雾霾颗粒中汽车尾气占20%以上,一致汽车尾气中的主要污染物为NOx、CO、燃烧源超细颗粒(PM2.5)等有害物质,其中PM2.5(OM单位为百万分之一米)颗粒大小约等于胶体粒子 | |
| D. | 如图所示为四大基本反应及其关系,则反应4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O属于区域3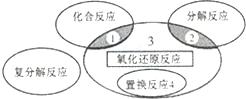 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
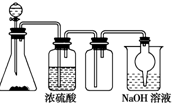 如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是
如图是一套实验室制取气体的装置,用于发生、干燥、收集和吸收有害气体,下列各组物质能利用这套装置进行实验的是| A. | MnO2和浓盐酸 | B. | Na2SO3(s)和较浓H2SO4 | ||
| C. | Cu片和浓HNO3 | D. | 浓氨水和生石灰 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.
氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的研究热点.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com