
分析 Al+NaNO3+NaOH-NaAlO2+N2↑+H2O中,Al元素化合价升高,被氧化,N元素化合价降低,被还原,结合化合价的变化判断电子的得失以及电子转移的方向和数目.
解答 解:(1)反应中N元素化合价由+5价降低到0价,被还原,在反应中得到电子,故答案为:N; 得到;
(2)反应中Al元素化合价由0价升高到+3价,则若有10个铝原子参与反应,则转移的电子总数为30,该反应中只有Al元素失电子化合价升高,Al元素化合价由0价变为+3价,所以10molAl完全反应转移电子的物质的量为30mol,则转移电子数为30NA;该反应中Al元素化合价由0价变为+3价,N元素化合价由+5价变为0价,根据方程式知,该反应中转移电子数是30,用双线桥表示电子转移方向和数目为 ,
,
故答案为:30;
点评 本题考查氧化还原反应,为高考常见题型,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念及转移电子的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 两种气体的物质的量之比为3:2 | B. | 两种容器的体积之比为2:3 | ||
| C. | 两种气体的分子数相等 | D. | 两种气体的密度之比是3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
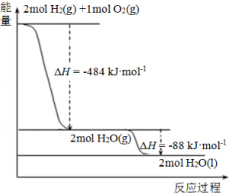
| A. | 926 kJ•mol-1 | B. | 485kJ•mol-1 | C. | 463 kJ•mol-1 | D. | 221 kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 相对密度(20℃) | 熔点 | 沸点 | 溶解性 | |
| A | 0.7137 | -116.6°C | 34.5°C | 不溶于水 |
| B | 0.7893 | -117.3°C | 78.5°C | 与水以任意比混溶 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 煤经过气化和液化两个物理变化,可变为清洁能源 | |
| B. | 自然界中含有大量的游离态的硅,纯净的硅晶体可用于制作计算机芯片 | |
| C. | 汽车尾气的大量排放影响了空气的质量,是造成PM2.5值升高的原因之一 | |
| D. | 明矾和氯气均可用于水的杀菌、消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②④⑥ | B. | ①②④ | C. | ①②③ | D. | ②③④⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com