
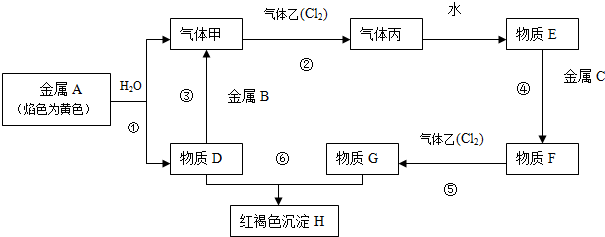
分析 金属焰色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2;判断C为Fe,据此答题.
解答 解:金属A焰色反应为黄色证明为Na,与水反应生成气体甲为H2,D为NaOH;金属B和氢氧化钠溶液反应,说明B为Al,黄氯色气体乙为Cl2,气体甲和氯气反应生成丙为HCl,物质E为盐酸溶液,物质D氢氧化钠和物质G为反应生成红褐色沉淀H为Fe(OH)3,G为FeCl3,推断物质F为FeCl2,判断C为Fe,
(1)依据分析B为Al,F为FeCl2,故答案为:Al;FeCl2;
(2)①反应是钠和水的反应,反应的离子方程式为:2Na+2H2O=2Na++2OH-+H2↑,
反应③是氢氧化钠和铝反应生成氢气和偏铝酸钠,反应的离子方程式为:2Al+2OH-+2H2O=2AlO2-+3H2↑,
反应⑤是氯化亚铁和氯气反应生成氯化铁的反应,反应的离子方程式为:Cl2+2Fe2+=2Fe3++2Cl-;
故答案为:2Na+2H2O=2Na++2OH-+H2↑;2Al+2OH-+2H2O=2AlO2-+3H2↑;Cl2+2Fe2+=2Fe3++2Cl-.
点评 本题考查了物质转化关系的分析推断,物质性质的应用主要考查常见单质及其化合物的性质应用,题目较简单.


科目:高中化学 来源: 题型:选择题
| A. | 该反应的焓变为负值 | |
| B. | 升高温度,逆反应速率减小 | |
| C. | 恒温恒容下,增大压强,H2浓度一定减小 | |
| D. | 该反应化学方程式为CO2+H2?CO+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 碳酸二甲酯资料 | |||||
| 简称 | 键线式 | 熔点 | 沸点 | 化学性质 | 用途 |
| DMC | 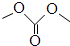 | 4℃ | 90.1℃ | 非常活泼、很易水解 毒性很低 | 有机合成中间体 |
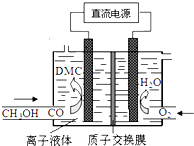 则下列说法正确的是( )
则下列说法正确的是( )| A. | 通O2区是阴极区,质子通过交换膜从阴极区移向阳极区 | |
| B. | 阳极反应:CO-2e-+2CH3OH═(CH3O)2CO+2H+ | |
| C. | 离子液体必须是水溶液,目的是传递电荷 | |
| D. | 电合成DMC的总反应方程式:CO+2CH3OH═(CH3O)2CO+H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | lmol FeI2与足量氯气反应时转移的电子数为2NA | |
| B. | 2L 0.5 mol•L-1硫酸钾溶液中阴离子所带电荷数为NA | |
| C. | 1mol Na2O2固体中含离子总数为3NA | |
| D. | 标准状况下,11.2L苯中含有分子的数目为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
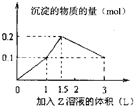
| A. | 偏铝酸钠、氢氧化钡、硫酸 | B. | 氯化铝、氯化镁、氢氧化钠 | ||
| C. | 氯化铝、氯化铁、氢氧化钠 | D. | 偏铝酸钠、氯化钡、硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com