
分析 (1)根据配制溶液的操作步骤判断所用仪器;
(2)根据Sn2+有较强的还原性来分析;
(3)根据得失电子数守恒来配平反应:Cr2O72-中Cr元素显+6价,后变为Cr3+的+3价,故1molCr2O72-得6mol电子,而1molFe2+变为Fe3+时失1mol电子,故根据得失电子数守恒可知,Fe2+的计量数为6,则Fe3+的计量数也为6,Cr2O72-的计量数为1,根据Cr原子的守恒,Cr3+的计量数为2;根据O原子的守恒,可知H2O的计量数为7;根据H原子的守恒,可知H+的计量数为14,据此进行分析;
(4)分析不当操作对溶质的物质的量和溶液体积的影响,依据C=$\frac{n}{V}$进行误差分析;
解答 解:(1)配制过程中使用的玻璃仪器有:溶解K2Cr2O7固体时要用烧杯、玻璃棒,配制溶液要用500ml容量瓶;定容时要用胶头滴管滴加蒸馏水至液面与刻度线相切;
故除烧杯和玻璃棒外,还需要500ml容量瓶和胶头滴管,
故答案为:500ml容量瓶;胶头滴管;
(2)Sn2+有较强的还原性,能将矿石中的Fe3+还原为Fe2+,从而能用强氧化剂K2Cr2O7来滴定,
故答案为:将矿石中的Fe3+还原为Fe2+;
(3)根据得失电子数守恒来配平反应:Cr2O72-中Cr元素显+6价,后变为Cr3+的+3价,故1molCr2O72-得6mol电子,而1molFe2+变为Fe3+时失1mol电子,故根据得失电子数守恒可知,Fe2+的计量数为6,则Fe3+的计量数也为6,Cr2O72-的计量数为1,根据Cr原子的守恒,Cr3+的计量数为2;根据O原子的守恒,可知H2O的计量数为7;根据H原子的守恒,可知H+的计量数为14,故配平后的反应:Cr2O72+6Fe2++14H+═2Cr3++6Fe3++7H2O,
故答案为:1;6;14;6;2;7;
(4)定容时,俯视刻度线,导致溶液的体积偏小,溶液的浓度偏大,则滴定的体积减小,故导致测得的铁含量偏低,
故答案为:偏低;
点评 本题综合考查了一定物质的量浓度溶液的配制、氧化还原反应的配平和滴定过程中易出现的问题分析,综合性较强,难度适中.


科目:高中化学 来源: 题型:选择题

| A. | 反应表明拆开N-C键比N-N键容易 | B. | 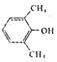 属于芳香醇的异构体有5种 属于芳香醇的异构体有5种 | ||
| C. | PHAC是一种酸式盐 | D. | PHAC能用于制造高能炸药 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 单质 | B. | 氧化物 | C. | 化合物 | D. | 有机物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若产物为NaClO、NaCl,则吸收后的溶液中n(ClO-)═n(Cl-) | |
| B. | 若产物为NaClO3、NaCl,则参加反应的氧化剂和还原剂的物质的量之比为1:5 | |
| C. | 若产物为NaClO、NaClO3、NaCl,则由吸收后溶液中n(Cl-)和n(ClO3-)可计算吸收的n(Cl2) | |
| D. | 若产物为NaClO、NaClO3、NaCl,则NaOH与Cl2相互反应的物质的量之比一定为2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 饱和纯碱(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L小苏打溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) | |
| D. | 等体积,pH=3的盐酸和醋酸分别与足量锌反应后,c(Cl-)=c(CH3COO-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ③④⑤ | D. | ①③④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径的大小顺序:r (W)>r (Z)>r (Y)>r (X) | |
| B. | 最高价氧化物对应的水化物的碱性:Y>Z | |
| C. | X、W的简单气态氢化物都易溶于水 | |
| D. | Z的最高价氧化物对应的水化物一定能溶于X的最高价氧化物对应的水化物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com