
| A、中和滴定时盛待测液的锥形瓶中有少量水对滴定结果无影响 |
| B、在酸碱中和滴定实验中,滴定管都需润洗,否则引起误差 |
| C、滴定时,左手控制滴定管活塞,右手握持锥形瓶,边滴边振荡,眼睛注视滴定管中的液面 |
| D、称量时,称量物放在称量纸上,置于托盘天平的左盘,砝码放在托盘天平的右盘 |


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
| A、向Ba(OH)2溶液中滴加稀硫酸:Ba2++2OH-+2 H++SO42-=BaSO4↓+2H2O |
| B、用CH3COOH溶解CaCO3:CaCO3+2H+═Ca2++H2O+CO2↑ |
| C、NH4HCO3溶于过量的KOH溶液中:HCO3-+OH-═CO32-+H2O |
| D、等物质的量的MgCl2、Ba(OH)2和HCl溶液混合:Mg2++2OH-═Mg(OH)2↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、澄清石灰水与稀盐酸反应Ca(OH)2+2H+=Ca2++2H20 |
| B、碳酸钠溶液与盐酸反应Na2CO3+2H+?=2Νa++H2O+CO2↑ |
| C、氢氧化铜与稀硫酸反应Cu(OH)2+2H+=Cu2++2H2O |
| D、稀硫酸与氢氧化钡溶液反应H++OH-+Ba2++SO42-=H2O+BaSO4↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
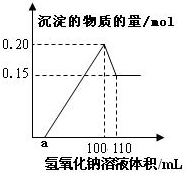 某实验小组对一含有Al3+的未知溶液进行分析,经定量分析后,给出沉淀的物质的量与滴入氢氧化钠体积的关系图:则下列说法中错误的是( )
某实验小组对一含有Al3+的未知溶液进行分析,经定量分析后,给出沉淀的物质的量与滴入氢氧化钠体积的关系图:则下列说法中错误的是( )| A、该未知溶液中至少含有3种阳离子 |
| B、滴加的NaOH溶液的物质的量浓度为5mol/L |
| C、若另一种离子为二价阳离子,则a=10 |
| D、若将最终沉淀过滤、洗涤、灼烧,其质量一定为6g |
查看答案和解析>>
科目:高中化学 来源: 题型:
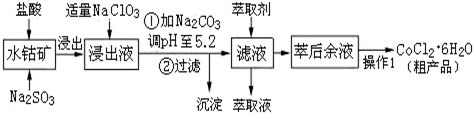
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:
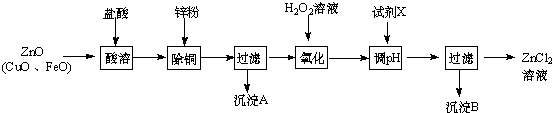
| 金属离子 | 开始沉淀的pH | 沉淀完全的pH |
| Fe3+ | 1.1 | 3.2 |
| Zn2+ | 5.2 | 6.4 |
| Fe2+ | 5.8 | 8.8 |
 )生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为
)生成丙交酯(C6H8O4)和聚乳酸,丙交酯的结构简式为查看答案和解析>>
科目:高中化学 来源: 题型:
| A、不能与KOH反应 |
| B、能和稀硫酸反应放出无色无味刺激性气味 |
| C、治疗胃酸过多的一种药剂 |
| D、在其水溶液中加入石灰水有白色沉淀产生 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、向CaCl2中通入少量的CO2 |
| B、Na2CO3溶液中加入过量CO2 |
| C、NaAlO2溶液中通入过量CO2 |
| D、Fe2(SO4)3溶液中加入过量KOH溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com