
【题目】下列溶液中,溶质的物质的量浓度不是1mol·L-1的是
A.将80gSO3溶于水并配成1L的溶液
B.10gNaOH固体溶解在水中配成250mL溶液
C.将0.5mol·L-1的NaNO3溶液100mL加热蒸发掉50g水的溶液
D.标准状况下,将22.4L氯化氢气体溶于水配成1L溶液
 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案科目:高中化学 来源: 题型:
【题目】nL三种气态烃混合物与足量氧气混合点燃后,恢复到原来状态(常温常压),体积共缩小2nL,这三种烃不可能的组合是 ( )
A. CH4、C2H4、C3H4以任意比混合
B. C2H6、C4H6、C2H2以2:1:2的物质的量之比混合
C. C3H8、C4H8、C2H2以11:14:26的质量之比混合
D. CH4、C3H6、C2H2以a:b:b体积比混合
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写下列化学方程式。
(1)铁和高温水蒸气反应的化学方程式:____________。
(2)向NaHCO3溶液中加入NaOH溶液的离子方程式:___________。
(3)Al2(SO4)3的电离方程式:_____________。
(4)钠和氧气在加热条件下反应的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设计如图装置研究电化学反应,a、b可用导线连接。下列叙述错误的是

A. a、b不连接时,铁片上有气泡产生
B. a、b连接时,铜片上发生反应:2H++2e→H2↑
C. a、b连接时,溶液中产生电子的定向移动
D. 无论a和b是否连接,铁片上都会发生氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知氯化铝的熔点为190℃(2.02×105Pa),但它在180℃即开始升华。
(1)氯化铝是________________(填“离子化合物”或“共价化合物”)。
(2)在500K和1.01×105Pa时,它的蒸气密度(换算成标准状况时)为11.92g·L-1,且已知它的结构中有配位键,氯化铝的化学式为________,结构式为________。
(3)无水氯化铝在空气中强烈地“发烟”,其原因是______________________。
(4)设计一个更可靠的实验,判别氯化铝是离子化合物还是共价化合物。你设计的实验是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是原子序数依次增大的五种短周期主族元素,其中A的原子序数是B和D原子序数之和的1/4,C的原子半径在所有短周期主族元素中最大,甲和丙是D元素的两种常见氧化物,乙和丁是B元素的两种常见同素异形体,0.005 mol/L戊溶液的pH=2,它们之间的转化关系如图所示(部分反应物省略),下列叙述一定正确的是
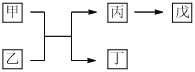
A. C、D两元素形成的化合物的原子个数比为1:2
B. C、E形成的化合物的水溶液呈碱性
C. 简单离子半径:D> C> B
D. 最高价氧化物对应水化物的酸性:E>A
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.据报道,我国在南海北部神狐海域进行的可燃冰(甲烷的水合物)试采获得成功。甲烷是一种重要的化工原料。
(1)甲烷重整是提高甲烷利用率的重要方式,除部分氧化外还有以下两种:
水蒸气重整:CH4(g)+H2O(g) ![]() CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+3H2(g) ΔH1=+205.9 kJ·mol-1 ①
CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
CO2(g)+H2(g) ΔH2=-41.2 kJ·mol-1 ②
二氧化碳重整:CH4(g)+CO2(g) ![]() 2CO(g)+2H2(g) ΔH3 ③
2CO(g)+2H2(g) ΔH3 ③
则反应①自发进行的条件是______________,ΔH3=______________kJ·mol-1。
Ⅱ.氮的固定一直是科学家研究的重要课题,合成氨则是人工固氮比较成熟的技术,其原理为N2 (g)+3H2 (g) ![]() 2NH3(g)。
2NH3(g)。
(2)在不同温度、压强和相同催化剂条件下,初始N2、H2 分别为0.1 mol、0.3 mol时,平衡后混合物中氨的体积分数(φ)如下图所示。

①其中,p1、p2 和p3 由大到小的顺序是______________________________,其原因是__________________________________________________________________。
②若分别用vA(N2)和vB(N2)表示从反应开始至达平衡状态A、B时的化学反应速率,则vA(N2)________vB(N2)(填“>”“<”或“=”)。
③若在250 ℃、p1 为105 Pa条件下,反应达到平衡时容器的体积为1 L,则该条件下B点N2 的分压p(N2)为_____________________Pa (分压=总压×物质的量分数,保留一位小数)。
Ⅲ.以连二硫酸根(S2O![]() )为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:
)为媒介,使用间接电化学法也可处理燃煤烟气中的NO,装置如图所示:

(3)①阴极区的电极反应式为_________________________________。
②NO吸收转化后的主要产物为NH![]() ,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
,若通电时电路中转移了0.3 mol e-,则此通电过程中理论上吸收的NO在标准状况下的体积为________mL。
Ⅳ、常温下,将a mol·L-1的醋酸与b mol·L-1Ba(OH)2 溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=___________(用含a和b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】双键完全共轭(单键与双键相间)的单环多烯烃称为轮烯,[8]轮烯(![]() )是其中的一种。下列关于该化合物
)是其中的一种。下列关于该化合物
的说法错误的是( )
A. 与苯乙烯互为同分异构体 B. 能使酸性高锰酸钾溶液褪色
C. 二氯代物有四种 D. 生成 1 mol C8H16 至少需要 4 mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学科研小组研究在其他条件不变时,改变某一条件对A2(g)+3B2(g)![]() 2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中,T表示温度,n表示物质的量),根据图示得出的结论正确的是
2AB3(g)化学平衡状态的影响,得到如下图所示的变化规律(图中,T表示温度,n表示物质的量),根据图示得出的结论正确的是

A. 反应速率a>b>c
B. 达到平衡时,AB3的物质的量大小为:b > c > a
C. 达到平衡时,A2的转化率大小为:b>a>c
D. 若T2>T1,则正反应一定是吸热反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com