
现有四种元素的基态原子的电子排布式如下:① 1s22s22p63s23p4; ②1s22s22p63s23p3;③1s22s22p5。则下列有关比较中正确的是( )
A.第一电离能:③>②>① B.原子半径:③>②>①
C.电负性:③>②>① D.最高正化合价:③>②>①
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源:2015-2016学年江西省高一上学期10月月考化学试卷(解析版) 题型:选择题
下列一定量的各物质所含原子个数按由大到小的顺序排列的是
①0.5 mol氨气 ②标准状况下22.4 L氦气 ③4 ℃时9 mL水 ④0.2 mol磷酸
A.①④③② B.④③②①
C.②③④① D.①④②③
查看答案和解析>>
科目:高中化学 来源:2016届山西怀仁第一中学高三上学期期中考试化学试卷(解析版) 题型:选择题
向一定量的盐酸中逐滴加入NaAlO2溶液,生成沉淀Al(OH)3的量随NaAlO2加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
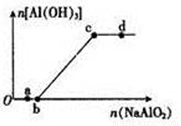
A.a点对应的溶液中: Na+、Fe3+、SO42-、HCO3-
B.b点对应的溶液中: Ag+、Ca2+、NO3-、H+
C.c点对应的溶液中: Na+、K+、SO42-、Cl-
D.d点对应的溶液中: K+、NH4+、I-、H+
查看答案和解析>>
科目:高中化学 来源:2015-2016河北石家庄第一中学高二上期中考试化学试卷(解析版) 题型:选择题
下列关于化石燃料煤、石油和天然气的说法中,不正确的是
A.石油是多种碳氢化合物的混合物,可据各组分沸点不同进行分馏利用
B.煤的气化、液化是物理变化,煤的干馏是化学变化
C.天然气的主要成分是甲烷
D.酸雨形成的主要原因是含硫化石燃料的大量燃烧
查看答案和解析>>
科目:高中化学 来源:2016届浙江省高三上学期期中考试化学试卷(解析版) 题型:填空题
在Cl-浓度为0.5 mol·L-1的某无色澄清溶液中,还可能含有下表中的若干种离子。
阳离子 | K+ Al3+ Mg2+ Ba2+ Fe3+ |
阴离子 | NO3- CO32- SiO32- SO42- OH- |
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 | 实验内容 | 实验结果 |
Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56 L气体 |
Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4 g |
Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
请回答下列问题。
(1)通过以上实验能确定一定不存在的离子是____ ____。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,请写出一定存在的阴离子及其浓度(不一定要填满)。
阴离子 | 浓度c/(mol·L-1) | |
① | ||
② | ||
③ | ||
④ |
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:________ _____。
查看答案和解析>>
科目:高中化学 来源:2016届辽宁沈阳市高三上学期期中考试化学试卷(解析版) 题型:选择题
向18.4 g铁和铜组成的合金中加入过量的硝酸溶液,合金完全溶解,同时生成NO2、NO混合气体,再向所得溶液中加入足量的NaOH溶液,生成30.3 g沉淀。另取等质量的合金,使其与一定量的Cl2恰好完全反应,则Cl2 的体积在标准状况下为( )
A.7.84L B.6.72L C.4.48L D.无法计算
查看答案和解析>>
科目:高中化学 来源:2016届江苏常州一中、江阴南菁高中高三两校联考化学卷(解析版) 题型:选择题
在2L密闭容器内,按物质的量之比为2︰1投入NO和O2。某温度下发生如下反应:
2NO(g) + O2(g) 2NO2(g),n(NO)随时间的变化如表:
2NO2(g),n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.015 | 0.012 | 0.010 | 0.010 | 0.010 |
下列说法不正确的是
A.在0~2s内,v(O2)=0.002mol·L-1·s-1
B.5s后向容器中通入0.02mol NO2,再次平衡后,0.020mol<n(NO2)<0.040 mol
C.在该温度时,向容器中加入O2,平衡将正向移动,平衡常数增大
D.5s后,向反应容器中同时通入各0.01mol的NO、O2、NO2,平衡向正向移动
查看答案和解析>>
科目:高中化学 来源:2016届河北正定中学高三上学期期中考试化学试卷(解析版) 题型:填空题
某碳素钢锅炉内水垢的主要成分是碳酸钙、硫酸钙、氢氧化镁、铁锈、二氧化硅等。水垢会形成安全隐患,需及时清洗除去。清洗流程如下:
Ⅰ.加入NaOH和N a2CO3混合液,加热,浸泡数小时;
a2CO3混合液,加热,浸泡数小时;
Ⅱ.放出洗涤废液,清水冲洗锅炉,加入稀盐酸和少量NaF溶液,浸泡;
Ⅲ.向洗液中加入Na2SO3溶液;
Ⅳ.清洗达标,用NaNO2溶液钝化锅炉。
(1)用NaOH溶解二氧化硅的化学方程式是 。
(2)已知:20℃时溶解度/g
CaCO3 | CaSO4 | Mg(OH)2 | MgCO3 |
1.4×10-3 | 2.55×10-2 | 9×10-4 | 1.1×10-2 |
根据数据,结合化学平衡原理解释清 洗CaSO4的过程 。
洗CaSO4的过程 。
(3)在步骤Ⅱ中:
① 被除掉的水垢除铁锈外,还有 。
② 清洗过程中,溶解的铁锈会加速锅炉腐蚀,用离子方程式解释其原因 。
(4)步骤Ⅲ中,加入Na2SO3的目的是 。
(5) 步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
步骤Ⅳ中,钝化后的锅炉表面会覆盖一层致密的Fe2O3保护膜。
① 完成并配平其反应的离子方程式:

②下面检测钝化效果的方法合理的是 。
a.在炉面上滴加浓H2SO4,观察溶液出现棕黄色的时间
b.在炉面上滴加酸性CuSO4溶液,观 察蓝色消失的时间
察蓝色消失的时间
c.在炉面上滴加酸性K3[Fe(CN)6]溶液,观察出现蓝色沉淀的时间
d.在炉面上滴加浓HNO3,观察出现红棕色气体的时间
查看答案和解析>>
科目:高中化学 来源:2015-2016学年青海西宁第十四中学高二上期中考试化学卷(解析版) 题型:选择题
有一化学平衡:mA(g)+nB(g) pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是
pC(g)+qD(g)(如右图)表示的是转化率与压强、温度的关系。分析图中曲线可以得出的结论是
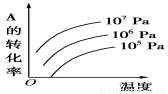
A.正反应吸热:m+n>p+q
B.正反应吸热:m+n<p+q
C.正反应放热:m+n>p+q
D.正反应放热:m+n<p+q
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com