
| A. | $\frac{a}{A+m}$(Z+m)mol 质子 | B. | $\frac{a}{A}$(Z+m)mol 电子 | ||
| C. | $\frac{a}{A+m}$(A-Z+m)mol 中子 | D. | $\frac{a}{A}$mmolHmX |
分析 核素AZX的质子数为Z,质量数为A,故中子数为(A-Z).故HmX的摩尔质量为(A+m)g/mol,据此求出agHmX的物质的量,然后结合HmX中含(Z+m)个质子、(A-Z)个中子来分析.
解答 解:核素AZX的质子数为Z,质量数为A,故中子数为(A-Z).故HmX的摩尔质量为(A+m)g/mol,故agHmX的物质的量n=$\frac{a}{A+m}$mol.
A.由于HmX中含(Z+m)个质子,故$\frac{a}{A+m}$的HmX中含$\frac{a}{A+m}$(Z+m)mol质子,故A正确;
B.质子数等于电子数,所以电子数为含$\frac{a}{A+m}$(Z+m)mol,故B错误;
C.由于H原子不含中子,故HmX中含(A-Z)个中子,故$\frac{a}{A+m}$的HmX中含$\frac{a}{A+m}$(A-Z)mol中子,故C错误;
D.agHmX的物质的量n=$\frac{a}{A+m}$mol,故D错误.
故选A.
点评 本题考查了原子的结构中质量数、质子数和中子数间的关系,应注意的是H原子中不含中子,难度不大.


 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4>H3PO4>HNO3 | B. | 氢化物稳定性:HF>H2O>H2S | ||
| C. | 碱性:KOH>NaOH>Mg(OH)2 | D. | 氧化性:F2>O2>N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y | ||
| W | Z | ||
| T |
| A. | T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 | |
| B. | 物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 | |
| C. | 由X、Y和氢三种元素形成的化合物中只有共价键 | |
| D. | X、Y、Z三种元素氢化物的沸点依次升高 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 次氯酸钙溶液中通人过量二氧化碳:ClO-+H2O+CO2=HCO3-+HClO | |
| B. | 硫酸型酸雨放置一段时间溶液的pH减小:2H2SO3+O2═2H2SO4 | |
| C. | 已知:Fe2O3(s)+3C(s,石墨)═2Fe(s)+3CO(g)△H=+489.0kJ/mol CO(g)+$\frac{1}{2}$ O2(g)═CO2(g)△H=-283.0 kJ/mol C(s,石墨)+O2( g)═CO2(g)△H=-393.5kJ/mol 则4Fe(s))+3O2(g)═2Fe2O3(s)△H=-1641.0kJ/mol | |
| D. | 在复盐NH4Fe(SO4)2溶液中逐滴加入Ba(OH)2溶液,可能发生的反应的离子方程式是:3NH4++Fe3++3SO42-+3Ba2++6OH-═3BaSO4↓+Fe(OH)3↓+3NH3•H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | O2、O3 | B. | 1H、2H+ | ||
| C. | ${\;}_{19}^{40}$K、${\;}_{20}^{40}$Ca | D. | H、D、T |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
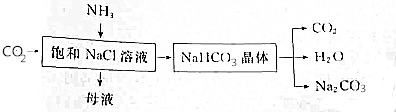
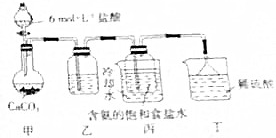
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com