
用下列实验装置进行相应的实验,能够达到实验目的的是( )


A.分离乙酸乙酯、碳酸钠和水的混合物
B.证明乙醇、浓硫酸共热生成乙烯
C. 实验室制取少量的硝基苯
D. 证明溴乙烷、NaOH、乙醇溶液共热生成乙烯
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
下列说法中正确的是
A.强电解质溶液的导电能力一定比弱电解质溶液的强
B.离子化合物中可能有共价键,共价化合物中肯定没有离子键
C.强电解质都是可溶性化合物,弱电解质都是难溶性化合物
D.NaCl晶体不导电是由于NaCl晶体中不存在离子
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1 g氢气完全燃烧生成水蒸气时放出热量121 kJ.且1 mol 氧气分子中的化学键完全断裂时吸收热量496 kJ,水蒸气中1 mol H―O键形成时放出热量463 kJ,则氢气中1mol H-H键断裂时吸收热量为
A. 920 kJ B. 557 kJ C. 436 kJ D. 188 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
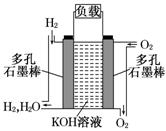 被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
被誉为改变未来世界的十大新科技之一的燃料电池具有无污染、无噪音、高效率的特点。右图为氢氧燃料电池的结构示意图,电解质溶液为KOH溶液,电极材料为疏松多孔石墨棒.当氧气和氢气分别连续不断地从正、负两极通入燃料电池时,便可在闭合回路中不断地产生电流.试回答下列问题:
(1) 写出氢氧燃料电池工作时正极电极反应方程式:_______
(2) 若将此燃料电池改为以肼( N2H4)和氧气为原料(其他条件不变),工作时(产物为N2 , H2O)负极电极反应式为______
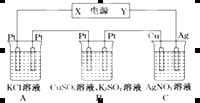
(3) 用上述氢氧燃料电池作直流电源进行电解,装置如下图所示。若通电5 min时,铜电极质量增加2.16 g。试回答:
① 电源中Y电极为直流电源的__________极。(填“正”或“负”)
② 通电5 min后B中pH变化:________,(填“增大”、“减小”或“不变”)。
③ 通电5 min时氢氧燃料电池中,理论上消耗标准状况下_______L氧气。
④ A中KCl溶液体积也是200 mL,通电5 min后,溶液的OH-浓度_______mol·L-1(设电解前后溶液体积无变化且KCl有剩余)。
⑤ 通电5 min时,B中共收集224 mL气体(标况),溶液体积为200 mL,则通电前CuSO4溶液的物质的量浓度为____________(设电解前后溶液体积无变化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
化学式为C8H10O的化合物A具有如下性质:
①A+Na—→慢慢产生气泡 ②A+RCOOH 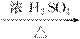 有香味的产物
有香味的产物
 ④其催化脱氢产物不能发生银镜反应
④其催化脱氢产物不能发生银镜反应
⑤脱水反应的产物,经聚合反应可制得一种塑料品(它是目前造成“白色污染”的主要
污染源之一)
(1)根据上述信息,对该化合物的结构可做出的判断是 。
A.苯环上直接连有羟基 B.苯环侧链末端有甲基 C.肯定有醇羟基 D.肯定是芳香烃
(2)化合物A的结构简式为 ;
(3)A和金属钠反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
制太阳能电池需要高纯硅,工业上用粗硅制高纯硅可通过以下反应实现:①Si(粗)+3HCl(g)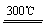 SiHCl3(g) + H2、 ②SiHCl3 (g) + H2
SiHCl3(g) + H2、 ②SiHCl3 (g) + H2 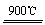 Si(纯) + 3HCl(g)
Si(纯) + 3HCl(g)
对上述两个反应的叙述错误的是
A.两个反应互为可逆反应 B.都是置换反应
C.都是氧化还原反应 D.都不是离子反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com