
【题目】下列说法正确的是( )
A.向AgCl饱和溶液中加入NaCl固体,c(Cl-)增大,Ksp增大
B.已知![]() 的
的![]() ,则所有含有固体MgCO3的溶液中,都有
,则所有含有固体MgCO3的溶液中,都有![]() ,且
,且![]()
C.可通过比较![]() 和
和![]() 的Ksp的大小比较它们的溶解性
的Ksp的大小比较它们的溶解性
D.25 ℃时![]() ,故新生成的 AgCl可转化为AgI
,故新生成的 AgCl可转化为AgI
【答案】D
【解析】
A、氯化银溶液中存在如下平衡:AgCl(s) =Ag+ (aq)+Cl-(aq),由于氯化钠的溶解度大于氯化银,加入NaCl固体,增大氯离子浓度,平衡向逆反应方向移动,析出氯化银沉淀,氯化银的溶解度降低,但温度不变,溶度积不变,故A错误;
B、含有固体MgCO3的溶液中,Mg2+和CO32-都能水解,水解后离子浓度不相等,并且在不同的温度下,溶度积不同,故B错误;
C、氢氧化镁和碳酸镁的组成结构不同,所以不能通过比较Mg(OH)2和MgCO3的Ksp的大小比较它们的溶解性,故C错误;
D、Ksp(AgCl)> Ksp( AgI),根据沉淀的转化原理可知,AgCl悬浊液中加入NaI溶液时,很容易转化为AgI悬浊液,故D正确;
故选D。


 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案科目:高中化学 来源: 题型:
【题目】材料是人类赖以生存和发展的重要物质基础,回答下列问题:
(1)下列生产工艺能获取新型无机非金属材料的是 ______ (填序号)。
①采用甲烷为原料,在微波和其他条件下生产金刚石
②采用传统方法用焦炭还原SiO2制备单晶硅
③在水泥生产过程中加入高炉矿渣生产特殊用途的水泥
④在玻璃生产过程中加入K、Pb生产其有特殊用途的光学玻璃
(2)某炼铁高炉中一次投入磁铁矿冶炼生铁,若该过程中转移的电子为1.60×105mol,不考虑其他的反应,也不考虑生铁中的杂质,则炼得的生铁为 ______t。生铁中含碳、硫等元素较多,炼钢是以生铁为原料,除去过多的碳、硫等杂质元素,其中除去硫的化学方程式为 ______。
(3)工业炼金属Al的工艺流程如下:
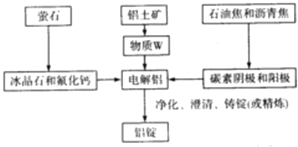
该工艺中冰晶石和氟化钙的作用是 ______,物质W的化学式为 ______ ;若铝土矿的纯度为60%,提取W的损失率为3%,电解时损失率为0.1%,粗铝净化时的损失率为2%,铝锭中铝的含量为99.9%,那么1.0t铝土矿可制备铝锭 ______t。
(4)金属腐蚀带来的损失无法估量。钢铁腐蚀多为吸氧腐蚀,其正极反应式为 ______,金属防腐措施很多,其中牺牲阳极(金属Zn)的阴极保护法的“阴极”反应式为 ______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点。一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池以空气中的氧气为氧化剂,以KOH溶液为电解质溶液。下列关于该电池的叙述错误的是
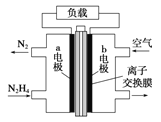
A.b极发生还原反应
B.a极的反应式为N2H4 - 4e-=N2↑+4H+
C.放电时,电流从b极经过负载流向a极
D.其中的离子交换膜需选用阴离子交换膜
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】废旧电池的危害上要集中在其中所含的少量重金属上。将废旧锌锰电池回收处理,既能减少它对环境的污染,又能实现废电池的资源化利用。
I.若碱性锌锰干电池的总反应为:2MnO2+Zn+2H2O=2MnO(OH)+Zn(OH)2 ,则该电池的正极反应式为:_________________________________
II.回收填料中的二氧化锰和氯化铵。已知:废旧干电池填料的主要成分为二氧化锰、炭粉、氯化铵和氯化锌等,其中氯化铵、氯化锌可溶于水。回收物质的流程如图所示。
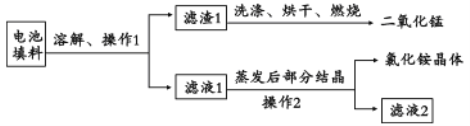
(1)① 操作中先将电池填料研碎的目的是:________________。操作l和操作2的名称都是___________,② 灼烧滤渣l的目的是______________________。
(2)回收二氯化锰:将废旧锌锰电池处理,得到含锰混合物,向该混合物加入浓盐酸并加热。①写出MnOOH与浓盐酸反应的化学方程式:________________。
② 锰回收新方法:向废旧锌锰电池内的混合物[主要成分MnOOH、Zn(OH)2]中加入一定量的稀硫酸和稀草酸(H2C2O4),并不断搅拌至无CO2产生为止,与使用浓盐酸回收锰相比,新方法的优点是___________(答l点即可)。
(3)部分难溶的电解质溶度积常数(Ksp)如下表:
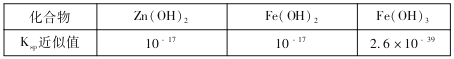
用废电池的锌皮可用于回收制作ZnSO4·7H2O。过程中,需除去锌皮中的少量杂质铁,其方法是:常温下,加入稀H2SO4和H2O2,铁溶解变为Fe3+,加碱调节pH为4,使溶液中的Fe3+转化为Fe(OH)3沉淀,此时溶液中c(Fe3+)=_________。继续加碱调节pH为____时,锌开始沉淀(假定Zn2+浓度为0.1mol/L)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】饮用水中NO3- 达到一定浓度时会对人类健康产生危害,为了降低饮用水中NO3 -的浓度,某兴趣小组提出如下方案:
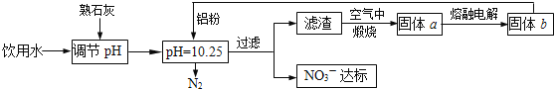
请回答下列问题:
(1)该方案中选用熟石灰调节 pH,理由是_______、__________、________, 在调节pH时,若pH过大或过小都会造成________的利用率降低。
(2)已知过滤后得到的滤渣是Al和Al(OH)3,则在溶液中铝粉和NO3-反应的离子方程式为____________________________________。
(3)用H2催化还原法也可降低饮用水中NO3-的浓度,已知反应中的还原产物和氧化产物 均可参与大气循环,则催化还原法的离子方程式为____________________________________。
(4)饮用水中的NO3-主要来自于NH4+。已知在微生物作用下,NH4+经过两步反应被氧化 成NO3-。两步反应的能量变化示意图如下:

试写出1molNH4+(aq)全部氧化成NO3-(aq)的热化学方程式是__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知室温时,0.1 mol/L某一元酸HA在水中有0.1%发生电离,下列叙述错误的是
A.该溶液的pH=4
B.升高温度,溶液的pH增小
C.此酸的电离平衡常数约为1×10-7
D.由HA电离出的c(H+)约为水电离出的c(H+)的105倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废气、汽车尾气排放出的![]() 、
、![]() 等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
等,是形成雾霾的重要因素。霾是由空气中的灰尘、硫酸、硝酸、有机碳氢化合物等粒子形成的烟雾。
(1)![]() 和
和![]() 在空气中存在下列平衡:
在空气中存在下列平衡:
![]() ;
;
![]()
![]()
![]() 通常在
通常在![]() 的存在下,进一步被氧化,生成
的存在下,进一步被氧化,生成![]() 。写出
。写出![]() 和
和![]() 反应的热化学方程式为______。
反应的热化学方程式为______。
(2)烟气中的![]() 可以用NaOH溶液吸收,将所得的
可以用NaOH溶液吸收,将所得的![]() 溶液进行电解,可循环再生NaOH,同时得到
溶液进行电解,可循环再生NaOH,同时得到![]() ,其原理如图所示。
,其原理如图所示。![]() 电极材料为石墨
电极材料为石墨![]()
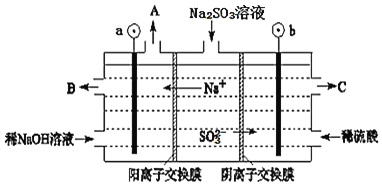
①图中a极要连接电源的______![]() 填“正”或“负”
填“正”或“负”![]() 极,C口流出的物质是______。
极,C口流出的物质是______。
②![]() 放电的电极反应式为______。
放电的电极反应式为______。
(3)常温下,烟气中![]() 被NaOH溶液吸收可得到
被NaOH溶液吸收可得到![]() 、
、![]() 等。
等。
①已知![]() 水溶液显碱性,原因是______
水溶液显碱性,原因是______![]() 写出主要反应的离子方程式
写出主要反应的离子方程式![]() ,该溶液中
,该溶液中![]() ______
______![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]()
②常温下,![]() 的
的![]() 溶液的
溶液的![]() ,则
,则![]() ______
______![]() 填写准确数值
填写准确数值![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究小组探究石蜡油裂解产物,设计如图实验。下列说法正确的是( )
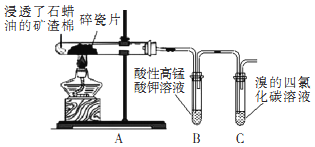
A.本实验能证明其产物含有碳碳不饱和键
B.两支试管中发生的反应类型相同
C.可观察到B和C试管中液体褪色和分层
D.实验完毕后先熄灭酒精灯后拆导管
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和20.00 mL 0.1000 mol/LCH3COOH溶液,得到2条滴定曲线,如下图所示:
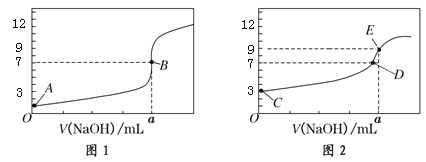
以下说法正确的是( )
A.图1是滴定CH3COOH 溶液的曲线
B.图2若用甲基橙作指示剂达到滴定终点时,则溶液由黄色变为红色
C.点D所示溶液中:c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
D.如果C、E两点对应的pH分别为3、9,则水电离的氢离子浓度之比为1∶106
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com