
| 编号 元素性质 | ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ |
| 原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| -2 | -3 | -1 | -3 |
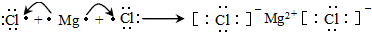 ;
;分析 ①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B,据此解答.
解答 解:①没有最高价、只有最低价-2,可推知①为O;③⑥都有最高价+1,处于ⅠA族,且⑥的原子半径较大,故③为Li、⑥为Na;②有最高价+2,处于ⅡA族,原子半径大于Li,故②为Mg;④⑦都有最高价+5、最低价-3,处于ⅤA族,且④的原子半径较大,故④为P、⑦为N;⑤有最高价+7、最低价-1,则⑤为Cl;⑧只有最高价+3,处于ⅢA族,原子半径小于P,故⑧为B.
(1)由上述分析可知,③的元素符号是Li,⑧的元素名称是硼,①为O元素,在元素周期表中的位置是第二周期第VIA族,故答案为:Li;硼;第二周期第VIA族;
(2)④为P、⑦为N,二者同主族,电子层越多非金属性越弱,故非金属性N>P,则氢化物稳定性NH3>PH3,故答案为:NH3>PH3;
(3)②和⑤组成的化合物为MgCl2,用电子式表示形成过程: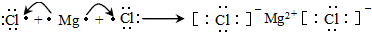 ,
,
故答案为: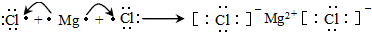 ;
;
(4)⑦的最高价氧化物对应水化物为硝酸,它的氢化物为氨气,二者反应的化学方程式为:NH3+HNO3=NH4NO3,故答案为:NH3+HNO3=NH4NO3;
(5)②最高价氧化物对应水化物为Mg(OH)2,⑤的氢化物水溶液为盐酸,二者反应的离子方程式为Mg(OH)2+2H+=Mg2++2H2O,故答案为:Mg(OH)2+2H+=Mg2++2H2O;
(6)“神舟”十号载人飞船内需要一种化合物来吸收航天员呼出的CO2,过氧化钠与二氧化碳反应生成氧气,该化合物为过氧化钠,由表中①⑥元素组成(填表中编号),用化学方程式表示吸收原理:2Na2O2+2CO2=2Na2CO3+O2,
故答案为:①⑥;2Na2O2+2CO2=2Na2CO3+O2.
点评 本题考查结构性质位置关系应用,难度中等,关键是根据化合价与原子半径推断元素,注意元素周期律的理解掌握.


 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:选择题
| A. | 能量变化如图所示的反应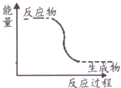 | |
| B. | 中和反应 | |
| C. | 化学键断裂吸收的热量比化学键生成放出的热量少的反应 | |
| D. | Ba(OH)2•8H2O晶体和NH4Cl晶体反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③④ | B. | ②③④ | C. | ①③④ | D. | ②③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:
VIA族的氧、硫、硒(Se)、碲(Te)等元素在化合物中常表现出多种氧化态,含VIA族元素的化台物在研究和生产中有许多重要用途.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “地沟油”经过加工处理后,可以用来制肥皂 | |
| B. | 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 | |
| C. | 汽车尾气污染物中含有氮的氧化物,是汽油不完全燃烧造成的 | |
| D. | 含磷污水是很好的肥料,可灌溉庄稼,可直接排放到自然界水体中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
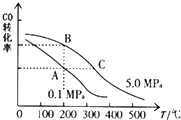 甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:
甲醇是一种可再生能源,具有开发和应用的广阔前景,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
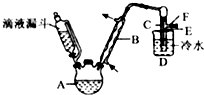 卤代烃在生产生活中具有广泛的应用,回答下列问题:
卤代烃在生产生活中具有广泛的应用,回答下列问题:| 乙醇 | 溴乙烷 | 溴 | |
| 状态 | 无色液体 | 无色液体 | 深红棕色液体 |
| 密度(g/cm3) | 0.79 | 1.44 | 3.1 |
| 沸点 | 78.5 | 38.4 | 59 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
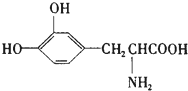 L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )
L-多巴是一种有机物,它可用于帕金森综合症的治疗,其结构简式如图:这种药物的研制是基于获得2000年诺贝尔生理学或医学奖、2001年诺贝尔化学奖的研究成果.下列关于L-多巴的叙述正确的是( )| A. | 只能与碱反应,不能与酸反应 | |
| B. | 1mol该物质最多与4molNaOH反应 | |
| C. | 该物质不能使酸性KMnO4褪色 | |
| D. | 1mol该物质最多可与1.5molHBr反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com