
| 时间/min | n(A)mol | n(C)mol |
| 0 | 0.3 | 0 |
| 1 | 0.15 | 0.15 |
| 2 | 0.1 | 0.2 |
| 3 | 0.1 | 0.2 |
| A. | x=1 | |
| B. | 反应开始2min内,用B表示的反应速率为0.05mol•L-l•min -1 | |
| C. | 反应进行到lmin时,反应体系达到化学平衡状态 | |
| D. | A的正反应速率等于C的逆反应速率时,反应体系达到化学平衡状态 |
分析 A.由表格数据可知,$\frac{0.3-0.15}{0.15}$=$\frac{x}{2}$;
B.v(C)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol•L-l•min -1,结合速率之比等于化学计量数之比计算;
C.1min时A的物质的量还在减小;
D.正逆反应速率相等时,达到平衡状态.
解答 解:A.由表格数据可知,$\frac{0.3-0.15}{0.15}$=$\frac{x}{2}$,解得x=2,故A错误;
B.v(C)=$\frac{\frac{0.2mol}{2L}}{2min}$=0.05mol•L-l•min -1,由速率之比等于化学计量数之比可知,反应开始2min内,用B表示的反应速率为0.025mol•L-l•min -1,故B错误;
C.1min时A的物质的量还在减小,2min时物质的量不再变化,反应体系达到化学平衡状态,故C错误;
D.正逆反应速率相等时,达到平衡状态,则A的正反应速率等于C的逆反应速率时,不同物质的正逆反应速率之比等于化学计量数之比,反应体系达到化学平衡状态,故D正确;
故选D.
点评 本题考查化学平衡计算,为高频考点,把握表格中数据应用、速率计算、平衡判断为解答的关键,侧重分析与应用能力的考查,注意选项D为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
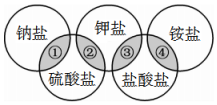 下列各项中的物质,能满足图中阴影部分关系的是( )
下列各项中的物质,能满足图中阴影部分关系的是( )| 物质 选项 | ① | ② | ③ | ④ |
| A | NaCl | KCl | K2SO4 | NH4Cl |
| B | Na2SO4 | K2SO4 | KCl | NH4Cl |
| C | NaCl | KCl | NH4Cl | K2SO4 |
| D | Na2SO4 | K2SO4 | KCl | (NH4)2SO4 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
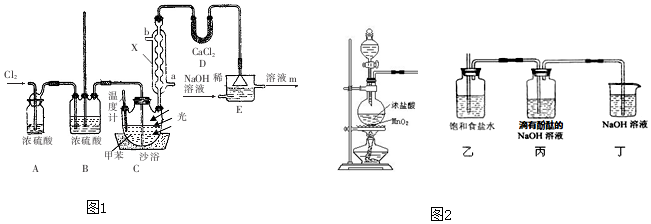
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 纽扣银锌电池体型小,含有害物质少,用后可以随意丢弃 | |
| B. | 化石燃料完全燃烧不会造成大气污染 | |
| C. | “低碳”生活倡导节能减排,应禁止使用化石燃料,减少污水排放 | |
| D. | 将煤气化后再燃烧可减少大气污染 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
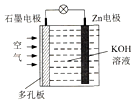 锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )
锌一空气电池(原理如图)适宜用作城市电动车的动力电源.该电池放电时Zn转化为ZnO.该电池工作时,下列说法正确的是( )| A. | Zn电极是该电池的正极 | |
| B. | Zn电极的电极反应:Zn+H2O-2e-═ZnO+2H+ | |
| C. | OH-向石墨电极移动 | |
| D. | 氧气在石墨电极上发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBH4与盐酸不反应 | |
| B. | NaBH4的电子式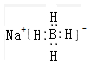 | |
| C. | 每生成1molFe,转移2mol电子 | |
| D. | 氧化产物与还原产物的物质的量之比为1:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加热稀盐酸和MnO2的混合物 | |
| B. | 在KMnO4中加入NaCl和浓H2SO4并加热 | |
| C. | KCl加硫酸并加KClO2再加热 | |
| D. | 浓盐酸中加入浓H2SO4并加热 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.
如图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com