
【题目】一种用铝土矿和硫铁矿烧渣(配料中含Al2O3、Fe2O3,FeO及SiO2等)为原料制备无机高分子絮凝剂聚合碱式氯化铝铁的流程如下:
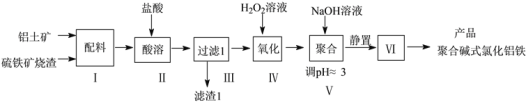
(1)步骤Ⅱ酸溶时,Fe2O3被溶解的化学程式为____,滤渣1的成分为____(填化学式)。
(2)步骤Ⅳ发生反应的离子方程式为________________。
(3)步骤V若将溶液pH调成6,可能造成的影响是_______;步骤Ⅵ包含的操作有_______。
(4)测定聚合碱式氯化铝铁{可表示为[FeaAlb(OH)xCly]n}中n(Al)/n(Fe)的比值的步骤如下:
步骤1.准确称取产品5.710g溶于水,加入足量的稀氨水,过滤,将滤渣灼烧至质量不再变化,得到3.350 g固体。
步骤2.另准确称取2.855g样品,溶于足量NaOH溶液,过滤,充分洗涤,将滤渣灼烧至质量不再变化,得到固体0.4000g。
计算产品中n(Al)/n(Fe)的比值(写出计算过程)。__________________________
【答案】Fe2O3 + 6HCl = 2FeCl3 +3H2O SiO2 2Fe2+ + H2O2 +2H+ = 2Fe3++2H2O 得到的是Fe(OH)3和Al(OH)3 过滤、洗涤和干燥 由步骤2 在2.855g样品中:160g·mol-1 × ![]() (Fe2O3) = 0.4000g,
(Fe2O3) = 0.4000g,![]() (Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al)/n(Fe)=
(Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al)/n(Fe)=![]()
【解析】
由流程图可知,铝土矿和硫铁矿烧渣酸溶时,Al2O3、Fe2O3和FeO与盐酸反应生成氯化铝、氯化铁和氯化亚铁,SiO2不与盐酸反应,过滤得含有氯化铝、氯化铁和氯化亚铁的滤液,滤渣1为没有反应的SiO2;酸性条件下,向滤液中加入双氧水溶液,氯化亚铁被双氧水氧化生成氯化铁;向反应后的溶液中加入氢氧化钠溶液,调节溶液pH为3,促进氯化铝和氯化铁的水解得到聚合碱式氯化铝铁,若溶液pH过大,可能会使氯化铝和氯化铁转化为Fe(OH)3和Al(OH)3沉淀,降低聚合碱式氯化铝铁的产率;静置后,过滤、洗涤和干燥得到聚合碱式氯化铝铁产品。
(1)步骤Ⅱ酸溶时,Fe2O3与盐酸反应生成氯化铁和水,反应的化学方程式为Fe2O3 + 6HCl = 2FeCl3 +3H2O;SiO2不与盐酸反应,过滤到的滤渣1为没有反应的SiO2,故答案为:Fe2O3 + 6HCl = 2FeCl3 +3H2O;SiO2;
(2)步骤Ⅳ为酸性条件下,氯化亚铁被双氧水氧化生成氯化铁,反应的离子方程式为2Fe2+ + H2O2 +2H+ = 2Fe3++2H2O,故答案为:2Fe2+ + H2O2 +2H+ = 2Fe3++2H2O;
(3)步骤V若将溶液pH调成6,溶液pH过大,可能会使氯化铝和氯化铁转化为Fe(OH)3和Al(OH)3沉淀,降低聚合碱式氯化铝铁的产率;静置后,过滤、洗涤和干燥得到聚合碱式氯化铝铁产品,故答案为:得到的是Fe(OH)3和Al(OH)3;过滤、洗涤和干燥;
(4)由步骤2 在2.855g样品中:160g·mol-1 × ![]() (Fe2O3) = 0.4000g,
(Fe2O3) = 0.4000g,![]() (Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al):n(Fe)=(2×0.025mol):(2×0.005mol)=5:1,故答案为:5:1。
(Fe2O3) = 0.0025mol,相当于5.710g样品中含n(Fe2O3) = 0.0050mol,由步骤1在5.710g样品中:102g·mol-1×n(Al2O3)+ 160g·mol-1×n(Fe2O3) = 3.350g,102g·mol-1×n(Al2O3) = 3.350g-2×0.4000g,n(Al2O3) = 0.025mol,n(Al):n(Fe)=(2×0.025mol):(2×0.005mol)=5:1,故答案为:5:1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】
我国科学家最近成功合成了世界上首个五氮阴离子盐(N5)6(H3O)3(NH4)4Cl(用R代表)。回答下列问题:
(1)氮原子价层电子对的轨道表达式(电子排布图)为_____________。
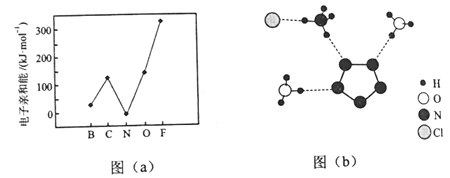
(2)元素的基态气态原子得到一个电子形成气态负一价离子时所放出的能量称作第一电子亲和能(E1)。第二周期部分元素的E1变化趋势如图(a)所示,其中除氮元素外,其他元素的E1自左而右依次增大的原因是___________;氮元素的E1呈现异常的原因是__________。
(3)经X射线衍射测得化合物R的晶体结构,其局部结构如图(b)所示。
①从结构角度分析,R中两种阳离子的相同之处为_________,不同之处为__________。(填标号)
A.中心原子的杂化轨道类型 B.中心原子的价层电子对数
C.立体结构 D.共价键类型
②R中阴离子N5-中的σ键总数为________个。分子中的大π键可用符号![]() 表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成的大π键原子数,n代表参与形成的大π键电子数(如苯分子中的大π键可表示为![]() ),则N5-中的大π键应表示为____________。
),则N5-中的大π键应表示为____________。
③图(b)中虚线代表氢键,其表示式为(NH4+)N-H┄Cl、____________、____________。
(4)R的晶体密度为d g·cm-3,其立方晶胞参数为a nm,晶胞中含有y个[(N5)6(H3O)3(NH4)4Cl]单元,该单元的相对质量为M,则y的计算表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化钾样品中含有少量碳酸钾、硫酸钾和不溶于水的杂质。为了提纯氯化钾,先将样品溶于适量水中,充分搅拌后过滤,再将滤液按如下图所示步骤进行操作(注意事项:①所加试剂必须过量;②过量试剂必须除去;③不能引入新的杂质)。

回答下列问题:
(1)试剂Ⅰ的化学式为_______,
(2)试剂Ⅱ的化学式为______,②中加入试剂Ⅱ的目的是_____。
(3)试剂Ⅲ的名称是_________,③中发生反应的化学方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化工厂排放出大量含硫酸铵的废水,技术人员设计如图所示装置处理废水中的硫酸铵,并回收化工产品硫酸和氨水,废水处理达标后再排放。下列说法错误的是

A. 离子交换膜1为阳离子交换膜,Y极发生氧化反应
B. a口进入稀氨水,d口流出硫酸
C. 阳极的电极反应式为2H2O-4e-=4H++O2↑
D. 对含硫酸铵较多的废水处理过程中若转移0.2mol电子,则可回收19.6gH2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2CO(g)+O2(g)=2CO2(g)ΔH=-566kJ/mol
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g)ΔH=-226kJ/mol
O2(g)ΔH=-226kJ/mol
根据以上热化学方程式判断,下列说法正确的是
A. CO的燃烧热为283 kJ
B. 如图可表示由CO生成CO2的反应过程和能量关系
C. 2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-452 kJ/mol
D. CO(g)与Na2O2(s)反应放出509 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以下非金属氧化物与其引起的环境问题及主要来源对应正确的是
选项 | 氧化物 | 环境问题 | 主要来源 |
A | CO2 | 破坏臭氧层 | 化石燃料的燃烧 |
B | SO2 | 温室效应 | 汽车尾气的排放 |
C | NO2 | 光化学烟雾 | 工厂废气的排放 |
D | CO | 酸雨 | 汽车尾气和化石燃料的不完全燃烧 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】本题为选做题,包括A、B两题。选学《化学与生活》模块的考生答A题,选学《有机化学基础》模块的考生答B题。每位考生只可选做1题,若两题都作答,则以A题计分。
A.《化学与生活》
(1)材料与人类吃、穿、住、行、用、医疗、通信等密切相关
①下列分子式或结构简式可表示维生素C的______(填字母)。
a.C6H8O6 b.C6H10O6 c.
②玻璃钢门窗被国际上称为继木、钢、铝、塑之后的第五代门窗产品。玻璃钢属于下列材料中的____(填字母)。
a.金属材料 b.无机非金属材料 c. 复合材料
③黏土是陶瓷的生产原料,其主要组成可表示为Al2Si2Ox(OH)4,则x=______(填字母)。
a.1 b.3 c.5
(2)绿色发展可使 “天更蓝,水更清,空气更清新,生活更美好”。
①传统的一次性塑料袋有聚氯乙烯、氯乙烯等,它们在环境中难降解易造成白色污染,合成聚氯乙烯的单体为_____(写结构简式)。
②燃煤产生的NO2是形成硝酸型酸雨的元凶,在催化剂及加热条件下用NH3与NO2反应可生成无毒无污染的气体,该反应的化学方程式为______。
③含铬(Cr2O72ˉ)的酸性废水处理方法之一可采用(NH4)2Fe(SO4)2将Cr2O72ˉ还原为Cr3+,再用氨水将Cr3+转变成难溶的Cr(OH)3。该方案运用了污水处理方法中的沉淀法和______。处理后的废水中因含有大量_____(填离子符号),能导致水体富营养化,还需进一步处理。
(3)保持营养平衡,合理使用药物是保证身心健康、提高生活质量的有效手段。
①有些氨基酸人体自身不能合成,要从外界才能获得,这些氨基酸称为________。苹果中含有一定量的铁元素,人体缺铁会导致的疾病是_____。
②含碘食盐中添加有KIO3,可用KI、盐酸及淀粉溶液检验,该反应的离子方程式为_______。
③人类历史上最重要的抗生素是_____(填名称);“铝镁加”是一种新型的抗酸剂,它的主要成分的化学式为:Al2Mg6(OH)14(CO3)2·4H2O,它与胃酸主要成分反应的化学方程式为______。
B.《有机化学基础》
(1)有机化合物的结构对其性质有着重要的影响。
①下列有机物易溶于水的是____(填字母)。
a. 乙烷 b.乙醇 c.乙酸乙酯
②下列有机物常温下呈气态的是_____(填字母)。
a.正丁烷 b.苯 c.溴乙烷
③分子式为C2H4O2的有机物中既能发生银镜反应又能发生水解反应的是_____(填字母)。
a.CH3COOH b.HOCH2CHO c. HCOOCH3
(2)芴酮可用作工程塑料的改进剂。某芴酮可通过下列反应得到:

①化合物Ⅱ中含氧官能团为____和_____(写名称)。
②鉴别化合物Ⅰ和化合物Ⅱ可用的试剂为_____(写化学式)。
③1mol化合物Ⅰ最多可与_____molNaOH完全反应。
(3)囧烷(E)的一种合成路线如下:
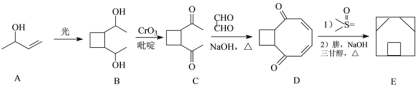
①A→B的反应类型为_____;B中手性碳原子数目为_____(填数字)。
②E的分子式______;A可用于合成一种常见的人造橡胶的单体,由A制备该单体的化学方程式为______。
③满足下列条件的D的同分异体的结构简式为_____。
Ⅰ.含有1个苯环,无其它环状结构,能与FeCl3溶液发生显色反应。
Ⅱ.核磁共振氢谱有4组峰且面积比为3∶3∶2∶2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、在528K、固定计提的容器中,反应CO(g)+2H2(g)CH3OH(g)过程中能量变化如图所示,曲线Ⅱ表示使用催化剂时的能量变化,若投入a molCO、2amolH2,平衡时能生成0.1amolCH3OH,反应就具工业应用价值。
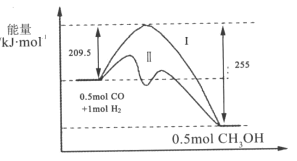
(1)该反应的热化学方程式为______;
(2)若按上述投料比使该反应具有工业应用价值,CO的平衡转化率为______;
(3)在容器容积不变的前提下,欲提高H2的转化率,可采取的措施______;(答出两项即可)
(4)关于反应历程Ⅰ与反应历程Ⅱ相比较,下列说法正确的是______;
A.反应历程Ⅱ比反应历程Ⅰ放出的热量少
B.反应历程Ⅱ比反应历程Ⅰ反应速率快
C.反应历程Ⅱ比反应历程Ⅰ平衡常数小
D.反应历程Ⅱ和反应历程Ⅰ中CO转化率相同
Ⅱ、已知:N2(g)+3H2(g)2NH3(g)△H=-92.1kJ/mol,在容器中充入1.4mol/LN2与4 mol/LH2,其中N2与NH3在达到平衡后改变某条件下的浓度变化如图所示
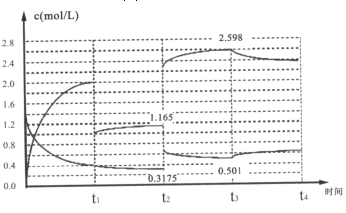
(5)t2时刻改变的条件为______;
(6)t2=t3时刻的平衡常数为______(mol/L)-2。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】核内中子数为N的R2+,质量数为A,则ng它的同价态氧化物中所含电子物质的量为( )
A.![]() (A+N-10)molB.
(A+N-10)molB.![]() (A-N+6)mol
(A-N+6)mol
C.(A-N+2)molD.![]() (A-N+8)mol
(A-N+8)mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com