
| A. | 在合成氨的工业生产中,使用较高温度有利于提高产量 | |
| B. | 在合成氨的工业生产中,加压有利于提高氨的产量 | |
| C. | 木炭粉碎后与O2反应,速率更快 | |
| D. | 由H2(g)、I2(g)、HI气体组成的平衡体系加压后颜色变深 |
分析 勒夏特利原理是如果改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动,勒夏特利原理适用的对象应存在可逆过程,如与可逆过程的平衡移动无关、与平衡移动无关,则不能用勒夏特利原理解释.
解答 解:A、合成氨反应为放热反应,升高温度不利用平衡向正方向移动,但升温却可提高反应速率,与勒沙特列原理不符,故A不选;
B、合成氨工厂通常采用高压(20MPa~50Mpa)条件,有利用平衡向正反应方向移动,可用勒夏特列原理解释,故B选;
C.木炭粉碎后,加大接触面积,加快发应速率,不能用勒夏特列原理解释,故C不选;
D、该反应反应前后气体体积不变,所以压强不影响化学平衡的移动,增大平衡体系的压强气体的体积减小,碘的浓度增大,颜色变深,所以不能用勒夏特列原理解释,故D不选;
故选B.
点评 本题考查勒夏特列原理知识,题目难度不大,注意使用勒夏特列原理的前提必须是可逆反应,且是否发生平衡的移动.


科目:高中化学 来源: 题型:解答题
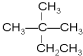 ④癸烷 ⑤CH3COOH
④癸烷 ⑤CH3COOH  ⑦
⑦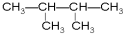 ⑧
⑧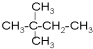 ⑨丙烷
⑨丙烷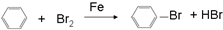 ;
; ;
;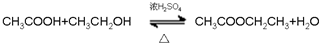 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑦ | ||||||
| 3 | ① | ③ | ④ | ⑥ | ⑧ | ⑨ | ⑩ | |
| 4 | ② |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
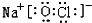 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | A | B | C | D |
| 实验装置 |  | 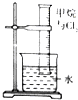 | 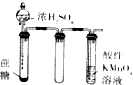 | 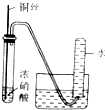 |
| 实验目的 | 提取苯中的Br2 | 探究甲烷的取代反应 | 检验浓硫酸的脱水性和强氧性 | 实验室制备并收集NO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2.4 g金属镁变成镁离子时失去的电子数目为0.1NA | |
| B. | 2 g氢气所含原子数目为NA | |
| C. | 1 mol MgCl2固体溶于水中,所得氯离子的数目为NA | |
| D. | 17 g氨气所含电子数目为10NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该化学反应的过程是吸热的 | |
| B. | 该化学反应的过程是放热的 | |
| C. | 分子运动速率加快,使反应物分子的碰撞机会增多 | |
| D. | 反应物分子的能量增加,活化分子百分数增加,有效碰撞次数增多 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com