
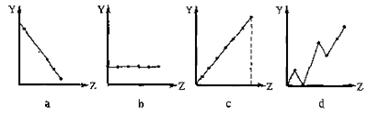
 ,B能促
,B能促  为 ▲ 。
为 ▲ 。科目:高中化学 来源:不详 题型:单选题
| 元素编号 | 元素性质或原子 结构 结构 |
| T | 失去一个电子后,形成Ne原子电子层结构 |
| X | 最外层电子数是次外层电子数的2倍 |
| Y | 其单质之一是空气中主要成分,最常见的助燃剂 |
| Z | 形成双原子单质分子,黄绿色气体 |
 (4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式 ▲ 。
(4)写出由T、Y和Z三种元素组成的一种化合物在水溶液中的电离方程式 ▲ 。查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| 加入溶液 | ①适量铋酸钠溶液 | ②过量的双氧水 | ③适量KI淀粉溶液 |
| 实验现象 | 溶液呈紫红色 | 紫红色消失,产生气泡 | 溶液变成蓝色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
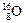 、
、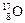 、
、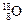 三种核素,氢元素有
三种核素,氢元素有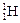 、
、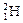 、
、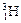 三种核素。
三种核素。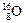 、
、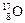 、
、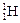 、
、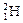 四种核数最多可以组成 种水分子。
四种核数最多可以组成 种水分子。 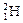 和
和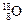 组成的水分子,其中含
组成的水分子,其中含 中子数为 mol,电子数为 个。
中子数为 mol,电子数为 个。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
① | | | | | | |||||||||||||||
| | ② | | ③ | ④ | ⑤ | ⑥ | | | ||||||||||||
| ⑩ | | | | | | ⑨ | | | ||||||||||||
| | | | | | ⑦ | | | | | ⑧ | | | | | | | | | ||
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 周期元素,它们的原子结构或性质如下表所示:
周期元素,它们的原子结构或性质如下表所示:
 子式为 .
子式为 .查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com