
| A. | ①②③④⑤ | B. | ①③⑤ | C. | ①②③⑤ | D. | ①③④⑤ |
 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案科目:高中化学 来源: 题型:选择题
| A. | 28 g氮气所含的原子数目为NA | |
| B. | 4 g金属钙变成离子时失去的电子数目为0.1NA | |
| C. | 22.4 L CH4的质量与NA个甲烷分子的质量之和相等 | |
| D. | 标准状况下,22.4 L CH4和氧气的混合物所含的分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如右图实验装置.依据实验设计,请回答:
工业纯碱中常常含有NaCl、Na2SO4等杂质.为测定某工业纯碱的纯度,设计了如右图实验装置.依据实验设计,请回答:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | H2O | B. | NaOH | C. | K2CO3 | D. | CH3COONa |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
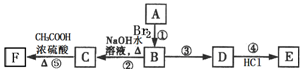
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | I->Fe2+>Cl->SO2 | B. | Cl->Fe2+>SO2>I- | C. | Fe2+>I->Cl->SO2 | D. | SO2>I->Fe2+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子序数:a>b>c>d | |
| B. | 离子半径:A(n+1)+>Bn+>C(n+1)->Dn- | |
| C. | 离子氧化性:A(n+1)+>Bn+离子还原性:C(n+1)->Dn- | |
| D. | C最高价氧化物的水化物的酸性比D的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 强电解质 | 弱电解质 | 非电解质 |
| A | CaCO3 | H2SiO3 | 酒精 |
| B | NaCl | NH3 | BaSO4 |
| C | Fe | CH3COOH | 蔗糖 |
| D | HNO3 | Fe(OH)3 | H2O |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
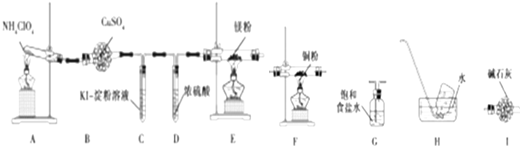
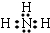 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com